Робинсон: десять именных и ошибка

 Согласно справочнику К.В.Вацуро и Г.Л.Мищенко «Именные реакции в органической химии» (Москва: Химия, 1976), английский химик Роберт Робинсон — один из наиболее выдающихся химиков-органиков. Его имя фигурирует (часто с соавторами) в десяти именных реакциях. Больше только у классика органической химии Эмиля Германа Фишера (1852—1919).
Согласно справочнику К.В.Вацуро и Г.Л.Мищенко «Именные реакции в органической химии» (Москва: Химия, 1976), английский химик Роберт Робинсон — один из наиболее выдающихся химиков-органиков. Его имя фигурирует (часто с соавторами) в десяти именных реакциях. Больше только у классика органической химии Эмиля Германа Фишера (1852—1919).
Роберт родился в 1886 году в богатой семье промышленников. После школы поступил в Манчестерский университет, намереваясь изучать математику. Но отец хотел, чтобы сын продолжил семейный бизнес — производство хлопчатобумажных материалов, и Роберту пришлось заняться химией. В то время химический факультет Манчестерского университета возглавлял Уильям Перкин-младший (1860—1929), сын знаменитого Перкина, синтезировавшего первый анилиновый краситель мовеин. Там же работал Хаим Вейцман, химик и будущий президент Израиля, а вместе с Робинсоном учился будущий лауреат Нобелевской премии по химии Уолтер Хоуорс. Роберт окончил университет в 19 лет с отличием, и Перкин пригласил его в свою лабораторию; там Робинсон изучал природные красители. Докторскую степень он получил в Манчестерском университете в 1910 году, что позволило ему занять должность профессора органической химии в Сиднейском университете. В последующие годы он занимал профессорские кафедры в университетах Ливерпуля, Манчестера, Лондона и Оксфорда, несколько лет был президентом Лондонского королевского общества.
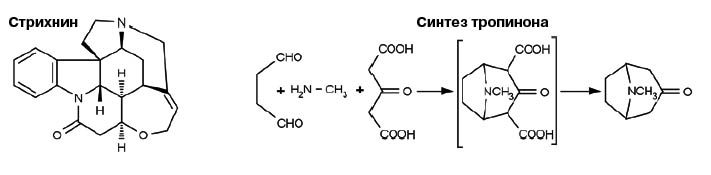
Выдающиеся достижения Робинсона связаны прежде всего с исследованием алкалоидов. Выяснение их строения и тем более синтез были тогда исключительно трудной задачей. Например, в 1910 году Робинсон опубликовал первую работу по изучению строения стрихнина: структура молекулы с шестью циклами (что правильно) содержала два атома азота в одном шестичленном цикле (что неверно). Лишь спустя 35 лет он пришел к правильной формуле. Синтезировать же стрихнин лишь через девять лет удалось Роберту Вудворду.
Робинсон за долгую жизнь успел многое: исследовать эфиры фосфорной кислоты и моносахаридов (6-фосфат D-глюкопиранозы называется эфиром Робинсона), синтезировать многие природные красящие вещества — антоцианы, установить строение и синтезировать многие алкалоиды. Он стал одним из создателей химии антибиотиков и внес вклад в теоретическую химию; кривые стрелки электронных смещений — его изобретение. В 1947 году ему была присуждена Нобелевская премия по химии «за исследование некоторых продуктов большой биологической важности, в первую очередь алкалоидов».
Известный химик-органик Рихард Мартин Вильштеттер, лауреат Нобелевской премии за 1915 год, синтезировал в 1901 году бициклический тропинон, предшественник синтеза атропина, который применяется в медицине. Ему пришлось провести почти два десятка последовательных стадий. А Робинсон мысленно расчленил молекулу тропинона на фрагменты: янтарный диальдегид, метиламин и ацетондикарбоновую кислоту. И при проведении реакции между этими тремя веществами тропинон был получен в одну стадию!
Робинсон был весьма разносторонним человеком. Он увлекался музыкой, фотографией, садоводством, туризмом, шахматами, вместе с Робертом Вудвордом основал журнал «Tetrahedron», завоевавший авторитет среди химиков во всем мире. При этом он был известен скверным характером и критическим отношением к коллегам. Робинсон мог упорно придерживаться неверных идей и сердился, если ему противоречили. Рассказывают, что он бросил чернильницу в коллегу, который осмелился усомниться в правильности предложенной Робинсоном структуры пенициллина (через два года выяснилось, что коллега был прав). Однажды Вудворд сказал: «Вообще-то сэр Роберт — совершенно несносная личность. Он не сказал ни единого доброго слова ни об одном химике в мире». Химик Владимир Прелог выразил сомнение, и Вудворд признал, что именно о Прелоге Робинсон однажды отозвался положительно: «Прелог, конечно, паршивый химик, но славный парень».
Был случай, когда сам Робинсон публично признался в ошибке. Она касалась состава нефти. Обычно в нефтях немного больше нечетных углеводородов, что объясняют декарбоксилированием жирных кислот в органических остатках (в них обычно содержится четное число атомов углерода). В 1966 году Дж.В.Бруннок опубликовал в «Nature» данные о преобладании в двух нефтяных месторождениях Ливии и Нигерии четных углеводородов в области С40 — C46. Робинсон в том же году и в том же журнале дал объяснение: если в земной коре при повышенных температурах и давлениях происходит распад молекул углеводородов с образованием осколков — свободных радикалов, то при их повторном случайном соединении должны образоваться преимущественно четные углеводороды. Рассуждал он так. Допустим, молекулы углеводородов случайным образом разрываются на два фрагмента, которые затем так же случайно рекомбинируют. При этом из «нечетного» углеводорода должен получиться один четный и один нечетный радикал. При случайном же разрыве на два фрагмента четной молекулы должны с равной вероятностью получиться либо два четных радикала, либо два нечетных. Значит, при большом числе разрывов мы получим одинаковое количество и тех и других. Это верно, но дальше Робинсон ошибся. Он считал, что если в случайном процессе встретятся два четных радикала, то новая молекула будет четной; то же произойдет при рекомбинации двух нечетных радикалов. Если же встретятся четный и нечетный, то получится «нечетная» молекула. Таким образом, имеются как будто два шанса против одного, что при случайной рекомбинации радикалов образуется углеводород с четным числом атомов углерода. Но это не так. И Робинсон сообщил о своей ошибке в короткой заметке, опубликованной 15 апреля 1967 года в «Nature». Вот что в ней говорилось: «В частном сообщении Дж.В.Бруннок обратил мое внимание на то, что простое арифметическое объяснение преобладания углеводородов с четным числом атомов углерода неверно. Поскольку, помимо рассмотренных ранее вероятностей для рекомбинации четное — четное, нечетное — нечетное и нечетное — четное, следует также добавить четное — нечетное. Таким образом, вероятность получить молекулы с четным и нечетным числом атомов углерода становится одинаковой, с чем мне следует согласиться. Так, если предположить, что четыре цепи разрываются с образованием четырех четных и четырех нечетных радикалов, то в результате их случайной рекомбинации имеется 32 шанса образования четной цепи и столько же шансов образования нечетной. И все же можно не сомневаться в том, что преимущественное образование н-алканов с четным числом атомов углерода происходит в результате деструкции жирных кислот и рекомбинации образующихся фрагментов».
Поразительно, но и в этой заметке Робинсон опять оплошал с арифметикой! Легко убедиться простым перебором, что, имея, например, четыре четных радикала, можно получить четный углеводород шестью способами, соединяя эти радикалы попарно. То же справедливо и для четырех нечетных радикалов, иными словами, всего есть 12 способов получить четный углеводород. Нечетные же углеводороды получаются перекрестной рекомбинацией четного и нечетного, и всего таких комбинаций может быть только 16. Таким образом, относительное содержание четных молекул будет 12/(12 + 16) = 0,428. Это же значение можно получить из теории вероятностей: (N - 1)/(2N - 1), где N — число четных или нечетных радикалов. Если N очень велико, то ответ будет в точности 0,5. Так что надо искать другие объяснения небольшому преобладанию четных молекул.
