
Подписаться
Подписаться
Мир вирусов, последний общий предок и происхождение ДНК

В предыдущих статьях мы восстанавливали картину древних событий по косвенным данным, например по результатам химических экспериментов. Теперь мы переходим к строению протоорганизмов, к попыткам установить, каким мог быть последний общий предок, он же LUCA (Last Universal Common Ancestor). Этот вопрос отчасти доступен прямому изучению методами сравнительной геномики.
Протоорганизмы цинкового мира дали начало двум весьма разным группам клеток — бактериям и археям. Кроме того, из сообщества протоорганизмов выделились несколько групп вирусов, и часть их древнее, чем разделение предков бактерий и архей. Сравнительная геномика позволяет нам строить родословные деревья генных семейств — устанавливать родственные связи между вариантами одного и того же гена у различных организмов и представлять их в виде древовидной структуры, примерно так же, как изображают связи между видами, отрядами и классами. Если дерево генного семейства совпадает с деревом одноклеточных организмов — на нем есть две отдельные большие ветви, бактериальная и архейная, — это веский аргумент в пользу того, что и последний общий предок имел гены данного семейства. Если же дерево генов имеет другой вид, значит, эволюционная история этого генного семейства была сложнее. Например, некоторые архейные представители генного семейства встречаются на бактериальной ветви и присутствуют в меньшинстве архей. Можно предположить, что ген зародился в линии бактерий, а затем произошел его горизонтальный перенос в некоторые группы архей. Напомним, что в отличие от вертикального переноса — передачи генов потомкам — есть и горизонтальный, когда генетический материал передается другому организму.
Вирусы, по-видимому, сопровождают остальные формы жизни со времен РНК-мира. Разнообразие их огромно — одно- и двухцепочечные ДНК-вирусы, ретровирусы, двухцепочечные РНК- вирусы, одноцепочечные РНК-вирусы с плюс- и минус-геномом... Их механизмы репликации столь же разнообразны, и не очень понятно, как одни могли произойти из других. Однако есть несколько характерных генов, которые встречаются во всех классах вирусов, а у клеточных организмов — никогда. Это JRC (jelly roll capsid protein) — один из типов капсидных белков, хеликаза S3H, инициирующая репликацию разных типов вирусных геномов, и упаковочная ATФаза, переносящая ДНК и РНК в собранные капсиды с затратой АТФ. Широкое распространение их генов означает, что вирусы с древнейших времен составляли единый «вирусный мир» и обменивались между собой генами, если одновременно заражали одного хозяина.
Сравнение прочитанных на сегодня геномов бактерий и архей показывает, что общий предок имел более 1200 семейств генов — уровень достаточно сложных современных бактерий. Удивительно, что в этот предковый набор входят гены множества разных метаболических путей, которые ныне не встречаются вместе в одной клетке. Получается, что общий предок мог «в одиночку» составлять целую экосистему с замкнутыми геохимическими циклами. В современной биосфере таких примеров практически нет. (Лишь недавно в золотой шахте на глубине более 2 км была найдена бактерия Desulforudis audaxviator, полностью обеспечивающая себя всем необходимым без помощи других видов, см. статью на сайте "Элементы".)
Следовательно, геном общего предка был достаточно велик — не менее миллиона пар нуклеотидов (для сравнения: длина генома кишечной палочки — около 4 миллионов пар нуклеотидов, длина самых маленьких геномов — паразитических бактерий рода Mycoplasma — около 700 тысяч пар нуклеотидов). У современных вирусов РНК-геномы не превышают 30 тысяч пар нуклеотидов, тогда как ДНК-геномы достигают 1,2 миллиона.
Что ограничивает размер РНК-геномов? Во-первых, цепь РНК легко разрывается ионами железа, щелочами и просто при высокой температуре. Во- вторых, одно из азотистых оснований — цитозин — в воде постепенно теряет аминогруппу (дезаминируется), превращаясь в другое основание, урацил. В-третьих, при образовании шпилек в РНК нередко возникают каталитические активные участки, которые катализируют собственное разрезание.
Все эти недостатки РНК устранены в ДНК. Она содержит дезоксирибозу, не имеющую 2'-гидроксильных групп, с которых начинается большинство реакций гидролиза. Эти же гидроксильные группы важны для каталитической активности РНК, поэтому ДНК в отличие от РНК не образует саморазрезающихся рибозимов. Наконец, вместо урацила в ДНК содержится его метилированный аналог — тимин, поэтому урацил, образовавшийся при дезаминировании цитозина, легко можно обнаружить и починить.
Как показано в ранних работах Манфреда Эйгена (еще в 1977 году он вместе с Петером Шустером предложил теорию гиперциклов, описывающую возможные пути самоорганизации молекул в пребиотическом мире), для поддержания структуры живой системы необходимо, чтобы в каждом новом поколении появлялось в среднем не более одной значимой, то есть сильно влияющей на приспособленность, мутации. Все современные организмы от мельчайших вирусов до бактерий (размеры геномов от 5 тысяч до 5 миллионов нуклеотидов) имеют частоту мутаций чуть ниже порога Эйгена, в пределах 0,5—1 за поколение. Животные и растения с большими геномами обошли это ограничение за счет избыточности многих генов и полового размножения (так, у человека в среднем происходит 30 новых мутаций за поколение), но вряд ли эти механизмы работали в РНК-мире.
Частота мутаций складывается из двух факторов: частоты ошибок полимеразы, копирующей геном, и частоты повреждений генома между репликациями. Точность работы РНК-зависимой РНК- полимеразы может быть выше, чем у современных вирусов, — в экспериментах по искусственному отбору точность РНК-полимеразы вируса желтой лихорадки была доведена до единственной ошибки на 5 миллионов нуклеотидов, почти как у бактериальных ДНК-полимераз («Journal of Virology», 2004, 78, 2, 1032—1038 . doi: 10.1128/JVI.78.2.1032-1038.2004). Но остается уязвимость РНК к гидролизу и дезаминированию цитозина: она-то и ограничивает РНК-геномы размером порядка 100 тысяч пар нуклеотидов.
Реакция синтеза дезоксирибозы очень сложна, связана с образованием опасных радикалов и катализируется сложными ферментами. Поэтому между РНК- и ДНК-геномами, скорее всего, были промежуточные стадии, простые в синтезе, но дающие преимущество в стабильности. Одной из таких промежуточных стадий мог быть метил-РНК-геном («Chemistry and Biology», 2000, 7, 12, R207—R216, doi: 10.1016/S1074-5521(00)00042-9). В современных рибосомных и некоторых других клеточных РНК отдельные 2'-гидроксильные группы рибозы метилированы. Это блокирует «паразитные» каталитические активности и защищает цепь РНК от гидролиза в этом месте. У архей и эукариот молекулы РНК метилирует один фермент при помощи «направляющих» малых ядрышковых РНК (мяРНК, snoRNA). Метилируется до 1—2% нуклеотидов рибосомной РНК в клетках, а в пробирке в отсутствие мяРНК тот же фермент может прометилировать до 8% нуклеотидов. Стабильность метил-РНК-генома могла отодвинуть предел Эйгена в несколько раз по сравнению с РНК-геномом — возможно, до 300 тысяч пар нуклеотидов.
Однако и такой размер генома недостаточен для кодирования всех белков, которые были у LUCA. Чтобы разрешить это противоречие, а также удивительное наличие дублирующих биохимических путей у одного организма, выдвигались радикальные идеи относительно неклеточной природы общего предка. Его представляли, например, в виде реплицирующихся генетических элементов, населяющих микронного размера поры в сульфидных отложениях горячих источников, где минеральные стенки отделяют протоклетки друг от друга, выполняя функцию мембран («Philosophical Transactions of the Royal Society, B, Biological Science», 2007, 362, 1887—1925, doi: 10.1098/rstb.2006.1881). Подобная стадия наверняка была в начале эволюции РНК-мира. Но в реконструированном наборе генов LUCA имеются гены мембранных белков, таких как вращающаяся АТФаза, — а значит, мембраны у него были.
В последнее время ученые (например, Евгений Кунин, «Annals of the New York Academy of Sciences», 2009, 1178, 47—64, doi: 10.1111/j.1749-6632.2009.04992.x) склоняются к представлению о LUCA как о сообществе реплицирующихся молекул РНК и ДНК, обитавшем на поверхности минералов, но имевшем липидные мембраны. (Об эволюции мембран мы расскажем в следующем номере.) Возможно, мембраны покрывали плоские скопления белков и нуклеиновых кислот на поверхности минерала, не давая им растворяться в воде, а также ограничивали свободно плавающие пузырьки — расселительные стадии плоских «организмов-сообществ», первые объекты, похожие на клетки. Одни репликаторы, составлявшие эти сообщества, обладали кооперативным поведением и в дальнейшем вошли в состав клеток. Другие паразитировали на сообществе — и стали предками вирусов. Горизонтальный перенос генов объединял эти репликаторы в достаточной степени, чтобы они не могли эволюционировать как раздельные биологические виды.
Что же нам говорит сравнительная геномика об истории различных клеточных систем?
Здесь надо пояснить некоторые термины. Ортологичными называются два гена, которые произошли от общего предка при разделении биологических видов. Паралогичными — гены, которые произошли от общего предкового гена при любом другом событии, например дупликации участков внутри одного генома. Гомологичными называются любые два гена, так или иначе произошедшие от предкового гена, то есть и ортологичные, и паралогичные. Нас интересуют ортологичные гены и их продукты (в таблице на сером фоне) — именно они, как уже говорилось, могли быть у общего предка.
Мы видим из таблицы, что система синтеза белков, или трансляции, у последнего общего предка уже пришла практически к современному виду — археи и бактерии отличаются лишь несколькими вспомогательными рибосомными белками. Несколько различается история аминоацил-тРНК-синтаз — они претерпели множество горизонтальных переносов, особенно между разными группами бактерий, видимо, потому, что они достаточно автономны, взаимодействуя только с консервативными тРНК и неизменными аминокислотами, но все они восходят к двум общим предкам.
Система транскрипции (синтеза РНК на матрице ДНК) тоже существовала у общего предка бактерий и архей, однако ее регуляция отличалась от современной. С учетом данных по системе репликации можно думать, что транскрипции подвергались не отдельные гены или опероны, а сразу целые плазмиды длиной в десятки тысяч нуклеотидов, причем инициация транскрипции могла происходить в той же точке, что и инициация репликации. Подобным образом работают крайне компактные кольцевые митохондриальные геномы животных.
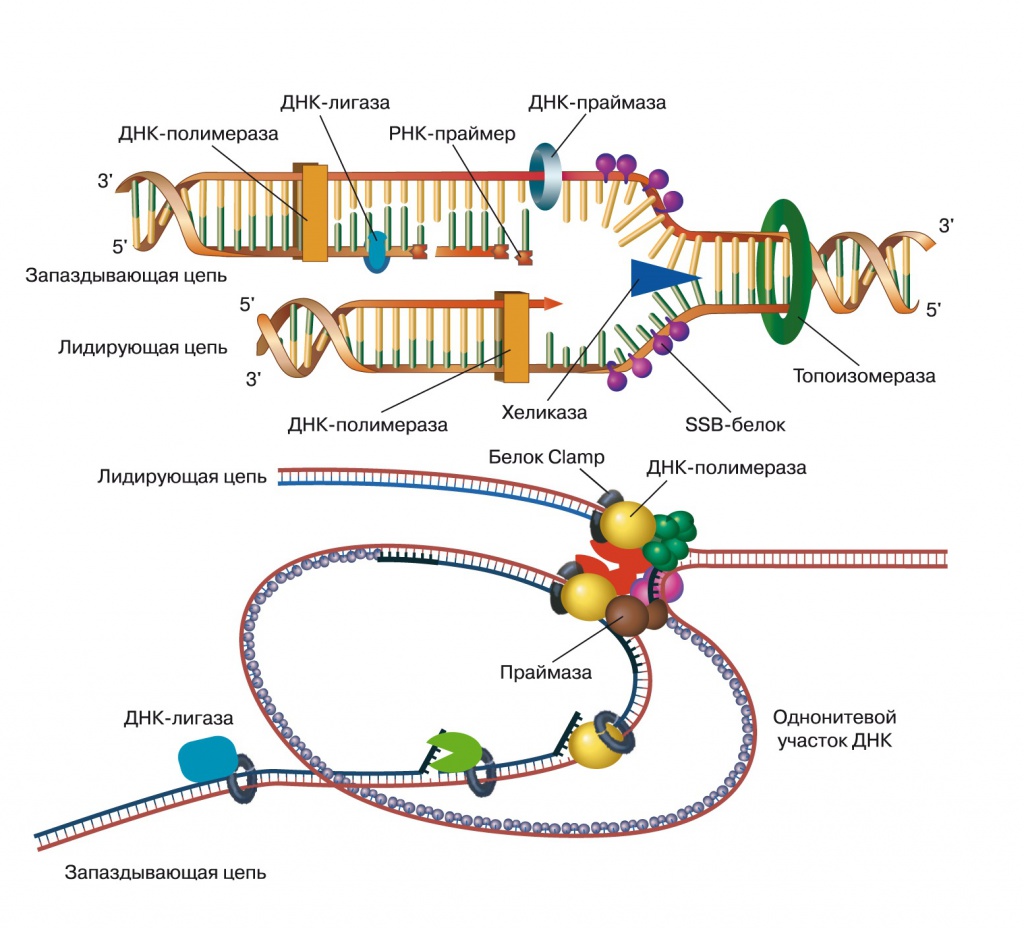
Система репликации ДНК сложнее, чем система транскрипции, и у клеточных организмов имеет форму репликативной вилки — комплекса более чем из 20 видов белковых молекул (рис. 1).
|
|
1. Репликативная вилка (вверху — схематично, внизу — более реалистично)
|
Напомним вкратце функции ее деталей:
— топоизомераза и хеликаза раскручивают исходную двунитевую ДНК;
— две молекулы главной ДНК- полимеразы копируют две цепи ДНК — лидирующую и запаздывающую;
— SSB-белки (от англ. single strand binding) связываются с однонитевой ДНК, стабилизируя ее;
— праймазы делают РНК-затравки (праймеры), с которых начинается синтез ДНК (один раз для лидирующей цепи и через каждые 500—2000 нуклеотидов для запаздывающей цепи);
— экзонуклеазы проверяют точность копирования за ДНК-полимеразами и удаляют неправильно вставленные нуклеотиды;
— вспомогательная ДНК-полимераза заменяет РНК-затравки на ДНК;
— ДНК-лигаза зашивает разрывы, остающиеся после удаления РНК-затравок;
— белок скользящей застежки (Clamp) удерживает всю конструкцию на ДНК, а Clamp loader с затратой энергии АТФ защелкивает Clamp в начале репликации.
Система репликации ДНК причудливо сочетает компоненты, унаследованные от общего предка, с независимо возникшими. Странно, что меньше всего сходства между бактериями и археями замечается в самых главных компонентах репликативной вилки — ДНК-зависимой ДНК-полимеразе и праймазах. Гомология вспомогательных компонентов, особенно Clamp и Clamp Loader, означает, что структура репликативной вилки, копирующей одновременно две цепи, уже существовала — для более простых механизмов, например по типу «катящегося кольца», они не требуются.
ДНК-полимеразы архей и бактерий не имеют в своей структуре ничего общего. Другие компоненты репликативной вилки, например хеликазы, проверочные экзонуклеазы, SSB-белки, хотя и обнаруживают сходство между бактериями и археями, при детальном рассмотрении выясняется, что они приняли одинаковые функции независимо.
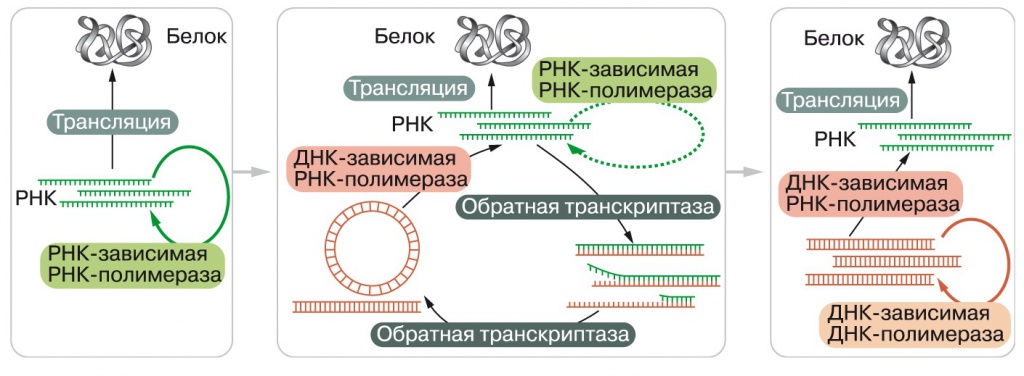
Получается, что у LUCA репликативная вилка функционировала без ДНК-зависимой ДНК-полимеразы, но ДНК уже существовала. Скорее всего, это говорит о том, что геном общего предка был гетеродуплексным — двунитевая ДНК-РНК молекула в кольцевой форме. Древняя репликативная вилка соответственно включала в себя обратную транскриптазу и ДНК-зависимую РНК-полимеразу. ДНК-РНК-гетеродуплексы прочнее, чем РНК и метил-РНК. Нельзя, впрочем, исключить и другой вариант, показанный на рис. 2 в середине: обратная транскриптаза строила ДНК-РНК-гетеродуплекс из геномной РНК, затем РНК гетеродуплекса разрушалась нуклеазами и ДНК достраивалась до двухцепочечной той же обратной транскриптазой. Завершался цикл репликации синтезом новой РНК на двухцепочечной ДНК-матрице. Эта схема полностью совпадает с репликационным циклом ретровирусов, но в ней нет места для полноценной репликативной вилки, хотя Clamp и Clamp Loader исходно могли помогать обратной транскриптазе.
|
|
2. Эволюция систем репликации (по: Leipe et al., 1999). От РНК-геномов к чередованию РНК и ДНК в жизненном цикле, как у ретровирусов, и, наконец, к репликации ДНК без участия РНК |
На момент выхода статьи, где впервые было предложено независимое происхождение ДНК-репликации бактерий и архей (D.D.Leipe, L.Aravind, E.V.Koonin, «Nucleic Acids Research», 1999, 27, 17, 2289—3401, doi: 10.1093/nar/27.17.3389, рис. 2, 3), разнообразие клеточных и вирусных ДНК-полимераз было изучено недостаточно, так, ДНК-полимераза бактерий оказывалась «сиротой» без родственников. Сейчас о ДНК-полимеразах мы знаем больше (см., например, «Biology Direct», 2006, 1, 39, doi: 10.1186/1745-6150-1-39), но картина их эволюции не вполне ясна. ДНК-полимераза архей и эукариот явно происходит от вирусных обратных транскриптаз, а среди ее более далеких родственников имеются вирусные РНК-зависимые РНК-полимеразы. Бактериальная ДНК-полимераза близких родственников не имеет, а отдаленное родство у нее прослеживается с нуклеотидилтрансферазами — ферментами, добавляющими нуклеотиды к одноцепочечным РНК и ДНК, без использования второй цепи как матрицы. Ферменты этой группы, например, добавляют сотни адениновых нуклеотидов к концам матричных РНК в клетках эукариот.
|
|
|
3. Эволюция генетических систем и появление вирусов (по: Leipe et al., 1999). Согласно этой схеме, репликация ДНК — позднее приобретение, и развивалась она у бактерий и архей независимо; общий предок обходился без нее. Римскими цифрами показаны стадии, обозначенные на рис. 2 |
Еще одна сложность на пути от РНК- геномов к ДНК-геномам — непонятно, в чем тут была прямая и непосредственная выгода для протоклетки. Основная выгода от смены геномной нуклеиновой кислоты на более устойчивую — возможность увеличить размер и сложность генома — доступна не сразу. Более того, новая полимераза поначалу, скорее всего, будет уступать в точности хорошо отработанной старой, что даже ухудшит приспособленность. Вирусолог Патрик Фортер («Biochimie», 2005, 87, 9—10, 793—803, doi: 10.1016/j.biochi.2005.03.015; «Research in Microbiology», 2009, 160, 7, 466—472, doi: 10.1016/j.resmic.2009.07.008) разрешает эту сложность. По его гипотезе, на эксперименты с новыми полимеразами «отважились» вирусы, а первой выгодой для них от смены типа генома было ускользание от защитных систем хозяина. Большинство клеток и в наше время используют разные ферментативные системы, опознающие и уничтожающие вирусные нуклеиновые кислоты, и «гонка вооружений» между клетками и вирусами могла вызвать очень быструю эволюцию геномных материалов и полимераз для их копирования. Кроме того, малый размер вирусных геномов снижает требования к точности репликации, а необходимость долгого автономного существования вириона без репарации и без УФ-защиты сульфида цинка ужесточает отбор на устойчивость вирусного генома по сравнению с геномом протоклеток. И сегодня у вирусов встречается разнообразные геномные нуклеиновые кислоты: примитивная ДНК с урацилом у фагов PBS1 и PBS2 («Current Opinion in Microbiology», 2002, 5, 5, 525—532, doi: 10.1016/S1369-5274(02)00360-0) и ДНК с дополнительными модификациями нуклеотидов («Molecular Biology and Evolution», 2005, 22, 6, 1444—1455, doi: 10.1093/molbev/msi132). Лишь после отработки в вирусах новые полимеразы были подхвачены хозяевами этих вирусов.
Теперь можно подвести итоги. С появлением белкового синтеза первые живые системы сильно расширили свои возможности обмена веществ и доступные экологические ниши. Они, вероятно, смогли заселить разные слои геотермальных отложений сульфида цинка, в том числе самые нижние, малодоступные для света, используя просачивающиеся сверху органические вещества и, возможно, хемосинтетические реакции. Первая белковая РНК-зависимая РНК-полимераза избавила рибозимы от необходимости катализировать собственную репликацию и позволила сильно увеличить количество генетической информации. Кроме того, белки стали промежуточным звеном, которое дало РНК возможность взаимодействовать с липидными мембранами. Так жизнь перешла из двумерной формы адсорбированных на минеральной поверхности полимеров к трехмерной форме — скоплениям биополимеров во впадинах и полостях минеральных отложений, затянутых примитивными мембранами.
Полная независимость от сульфида цинка тогда была еще невозможна, но появились первые структуры, похожие на клетки, — пузырьки, закрытые мембраной со всех сторон, плавающие в воде. Поначалу они были расселительными стадиями плоских, сидящих на минералах протоорганизмов. Геном таких протоорганизмов состоял, по всей видимости, из множества разных молекул РНК, одно- или двухцепочечных, линейных и кольцевых. Механизмы их репликации, скорее всего, напоминали таковые у РНК-вирусов, их размер тоже соответствовал размеру РНК-вирусных геномов (в пределах 30 тысяч нуклеотидов). Даже 30 тысяч нуклеотидов едва хватает, чтобы кодировать систему трансляции с ее рРНК, тРНК, рибосомными белками и другими факторами.
|
|
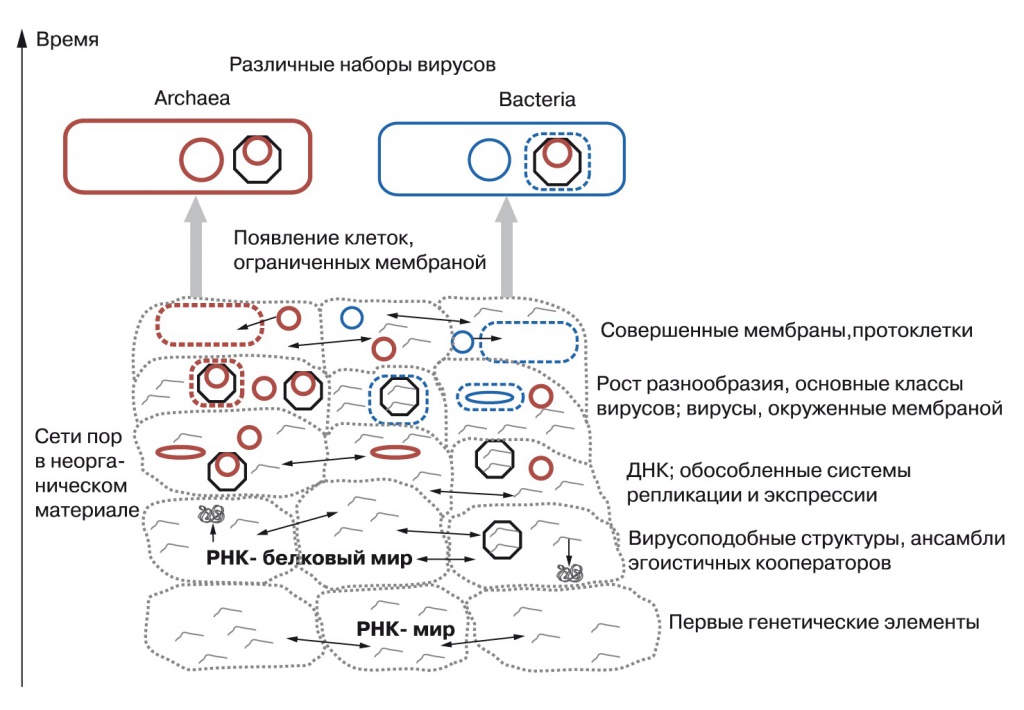
4. Эволюция «вирусного мира» и происхождение из него первых клеток (Koonin, 2009). Восьмиугольники — капсиды вирусов, пунктирные рамки — липидные оболочки вирусов, точечные рамки – стенки минеральных полостей |
Возможно, в протоорганизмах существовала «доминирующая» молекула РНК, которая кодировала РНК-полимеразу и главные компоненты аппарата трансляции, и многочисленные РНК-плазмиды, кодирующие ферменты биосинтеза, средства защиты и взаимодействия с внешним миром. При делении протоорганизмов далеко не всегда в каждую новую протоклетку попадал весь набор РНК, и, скорее всего, отложения ZnS были заселены сложным сообществом биохимически и экологически различных протоорганизмов. Однако они сохраняли генетическое единство благодаря сильнейшему горизонтальному переносу генов. Наряду с полезными плазмидами уже тогда должен был существовать весь спектр эгоистичных генетических элементов: от маленьких, ничего не кодирующих вироидов и специализированных вирусов с белковыми капсидами до внутригеномных паразитов, таких, как интроны I типа, РНК-аналогов современных ДНК-транспозонов и частично эгоистичных плазмид.
Вирусы в ходе «гонки вооружений» со своими хозяевами — плоскими протоорганизмами — создали новые типы нуклеиновых кислот, такие, как метил-РНК, урацил-ДНК и тимин-ДНК. Эти новые нуклеиновые кислоты были затем подхвачены протоорганизмами и позволили им увеличить размер и стабильность генома. Изобретение ДНК и совершенствование механизмов ее копирования шли параллельно в разных линиях вирусов, что привело к большому разнообразию ферментов, работающих с ДНК. Наконец, появление высокоточной ДНК-ДНК-репликации подготовило почву для объединения разнообразных генетических элементов в единые большие ДНК-геномы, а затем состоялся исход бактериальных и архейных клеток из древнего «цинкового мира».
Элементы жизни: почему не кремний и не фтор
Фотохимия и «черные курильщики»
Пути восстановления углекислого газа
Происхождение белкового синтеза и генетического кода
Мир вирусов, последний общий предок и происхождение ДНК
Происхождение мембран и мембранной биоэнергетики
Закат «цинкового мира», прокариотная биосфера и происхождение фотосинтеза