Натрий: факты и фактики
Натрий, 11-й элемент Таблицы Менделеева. Это мягкий металл, который плавится в кипящей воде, но этого с ним никто не проделывает, поскольку натрий при взаимодействии с водой взрывается. Поэтому его хранят под слоем керосина. Впервые натрий получил в 1807 году Гемфри Дэви электролизом соды; на долю натрия приходится 2,64% массы земной коры и 2,9% гидросферы; в природе встречается только в виде солей, самые известные минералы — каменная соль галит, содержащая хлорид натрия, глауберова соль, или мирабилит, содержащая сульфат натрия, чилийская селитра — азотнокислый натрий и трона — карбонат натрия. У человека натрий концентрируется в плазме крови, поте и моче. Эти факты науке известны давно, и казалось, что мы знаем о натрии все. Однако XXI век ставит новые задачи даже для издавна известных технологий, связанных с натрием, и находит ему новые применения…
Как из натрия зажигают звезду в мезосфере? С помощью мощного лазерного луча. В верхней части атмосферы, мезосфере Земли, на высоте 90 км, имеется тонкий слой натрия. Это не наша уникальная особенность — натрий есть в атмосфере и других планет, например Юпитера, что астрономы наблюдали по характерному свечению во время падения в него кометы Шумейкеров–Леви в июле 1994 года. Откуда натрий взялся в атмосфере планет, не очень понятно. Люди же научились использовать его для своих целей. При подсветке лазером с длиной волны 589 мм натрий возбуждается и начинает сиять оранжевым светом. Такой свет используют в уличных противотуманных фонарях, где газообразный натрий возбуждают электричеством. А если на Земле поставить мощный лазер, направить его вверх и осветить какой-то участок мезосферы, то расположенный там натрий также возбудится и на небесной сфере засияет рукотворная оранжевая звезда. Ее используют для юстировки наземных гигантских телескопов: параметры искусственной звезды известны, и, наблюдая ее, можно рассчитывать поправки на турбулентности атмосферы, которые искажают изображения настоящих звезд. Этот метод придумали в 80-х годах для работ по Стратегической оборонной инициативе, а для мирных целей его начали применять в 2000-х. В 2007-м в Южной европейской обсерватории (Чили) собрали первую установку для зажигания натриевых мезосферных звезд, а с 2016 года там действуют уже четыре установки, которые обеспечивают работу самых больших телескопов Земли.
 |
|
Четыре 22-ваттных лазера зажигают натриевую звезду над Большим и Малым Магеллановыми облаком |
Откуда берется натрий во Вселенной? Он формируется в тяжелых звездах в результате горения углерода или неона. В легких звездах натрий не образуется, а оказывается в них в составе той пыли, что осталась от взрыва звезд предыдущих поколений. Измеряя содержание натрия, можно установить, к какому поколению принадлежит легкая звезда. Изучение обогащения натрием звезд, которое проводил Симон Кемпбелл из мельбурнского Университета Монаша со своими коллегами («Nature», 2013, 7453), дало неожиданный побочный результат. Суть дела такова. Легкие звезды, массой с Солнце или несколько больше, в конце своей жизни становятся красными гигантами, у которых закончился водород в ядре. В результате горение продолжается лишь во внешних слоях, где водород остался, а ядро занято не горящим до поры до времени гелием. Это не последняя стадия эволюции — в самом конце звезда встает на так называемую асимптотическую ветвь гигантов. Следуя по ней, звезда периодически расширяется и сжимается, выбрасывая при этом огромное количество пыли. До недавнего времени астрофизики считали, что такова судьба всех легких звезд. Но вот наблюдения за натрием показали: на асимптотическую ветвь уходят только звезды первого поколения, у которых натрия мало. А звезды второго поколения, где натрия много, такой судьбы избегают и погибают раньше, не успев запылить межзвездное пространство. Если это так, астрофизикам надо существенно менять свое представление об эволюции Вселенной и происхождении в ней пыли, которая очень важна — из нее формируются новые звезды и планеты.
 |
| Ледяной Лев — уникальная звезда, которая находится на последней стадии, — она уже перестала быть асимптотическим гигантом, но еще не стала планетарной туманностью. Подобное крыльям бабочки облако вокруг нее состоит из выброшенной звездой пыли, газа и огромного количества льда, за что звезда и получила свое имя |
Какое самое важное для жизни на Земле соединение натрия? Это хлорид натрия, из которого в основном состоит поваренная соль. Он придает соленость практически всем поверхностным водам планеты, и прежде всего водам Мирового океана. Поскольку жизнь зародилась именно в нем, неудивительно, что хлорид натрия оказался жизненно важным соединением: он обеспечивает и соленость внутренних вод живых организмов. Зародись жизнь в каком-то другом океане, может быть, удалось бы обойтись и без натрия, но для живых существ на Земле именно хлорид натрия стал главным электролитом, содержащим ионы натрия, которые регулируют осмотическое давление в клетках и обеспечивают их обмен водой и другими веществами с окружающей средой. Ионы натрия также отвечают за поддержание кислотности крови, участвуют в регулировании деятельности клеток, обеспечивают прохождение нервных импульсов. Наш организм разными способами старается поддерживать постоянным содержание натрия в главной своей жидкости — плазме крови. А для восполнения запасов натрия, который выходит из организма с мочой и потом, люди, да и не только они, приспособились есть соль. Сейчас люди в год съедают почти 30 млн тонн соли.
Благодаря свойству натрия определять осмотическое давление, поваренная соль стала важнейшим консервантом: подавляющее большинство бактерий не выдерживает высокую концентрацию соли — различие в концентрации соли внутри и вне клетки ведет к тому, что вода устремляется вовне и бактерия погибает. При отсутствии холодильников соление было важнейшим способом длительного хранения съестного. Неудивительно, что в древности соль ценили на вес золота: она служила деньгами (причем в Африке еще в начале ХХ века), из нее делали самые настоящие монеты, есть даже предположение, что от слова «соль» пошло название денег — сольди, а также служащих за сольди наемников — солдат, которым, действительно, еще с римских времен плату зачастую выдавали солью. Как мы знаем из истории страны, ограничения в снабжении солью приводят к бунтам. Владельцы соляных приисков порой становились могущественнейшими магнатами, как, например, род Строгановых, история возвышения которого начинается с эксплуатации уральских залежей каменной соли.
Те, кто имел доступ к соленым озерам или морям, получали натрий из морской воды, выпаривая ее, а те, кто жил вдали от моря и соляных месторождений, довольствовались золой растений, аккумулирующих много натрия. Возможно, такая соль была полезней, ведь в ней наряду с натрием есть много калия. Впрочем, речь о вредности натрия пойдет ниже.
 |
|
Галит — главный минерал, в виде которого хлорид натрия отлагается в земных недрах |
Как натрий формировал технологическую цивилизацию? Хлорид натрия важен для жизни — и человека, и социума. А вот карбонат натрия, сода, Na2CO3 — один из тех нескольких столпов, которые держат всю технологическую цивилизацию. Без соды невозможно производство, казалось бы, простейших предметов. Нужно сделать мыло? Для этого требуется сварить жир либо масло с содой и получить мыльное вещество — стеарат натрия. Нужно стекло? Опять-таки надо сплавить песок с мелом и содой. Нужна щелочь? И здесь не обойтись без соды. Даже пресный хлеб не выйдет без соды — при своем разложении она дает пузырьки углекислого газа, обеспечивающие хлебу пористость. В 2020 году мировой объем производства соды превышал 60 млн тонн, что обеспечивает ей десятое место в списке всех веществ, производимых человечеством, за исключением нефтехимии.
Откуда берется сама сода? Поскольку карбонат натрия растворим в воде, месторождения соды немногочисленны. Сейчас крупнейшие запасы содового минерала, троны, Na2CO3⋅NaHCO3⋅2H2O, сосредоточены в США: 40% мировых. Промышленную добычу ведут также в КНР, Ботсване. В Кении соду извлекают из бездонного источника — содового озера Магади, где трона постоянно образуется сама собой из горячих подземных вод, насыщенных карбонатом натрия; местами толщина отложений троны превышает 40 метров.
В античном Средиземноморье месторождения содового минерала натрона, Na2CO3⋅10H2O, были только в Египте — оттуда соду развозили по всему миру. Остальным приходилось довольствоваться содовой золой — продуктом сжигания растений. Большой популярностью в средневековой Европе пользовалась зола солелюбивых суккулентов, которую промышленно заготавливали в Испании и на Канарских островах, — в ней доля карбоната натрия составляет 20%. По-русски эти растения называют солянками, а по-английски — glasswort, то есть стекольное сусло, что явно указывает на их важную роль в производстве стекла. Кстати, по-английски и соду до сих пор называют soda ash, то есть содовая зола.
К концу XVIII века, по мере индустриализации, выяснилось: сода из золы перестала удовлетворять нужды промышленности. Первыми меры для исправления дефицита предприняли во Франции — по требованию короля Людовика XVI Французская академия наук объявила конкурс на создание технологии производства соды из морской соли. Конкурс выиграл придворный химик герцога Орлеанского Никола Леблан — он предложил обрабатывать поваренную соль серной кислотой и мелом: получающуюся соляную кислоту удаляли кипячением, а соду отделяли от плохо растворимого сульфида кальция с помощью воды.
Леблану не повезло — во время Великой французской революции имущество герцога, в частности фабрику Леблана, реквизировали, а патент раскрыли для всех желающих. Почти полвека соду делали придуманным им способом. Однако в 1860-м бельгиец Эрнест Сольвей предложил гораздо более дешевый процесс получения соды из поваренной соли, мела и аммиака. Отходом этого процесса служит хлорид кальция. В 1930 году китайский химик Хоу Дэбан модифицировал процесс так, что в качестве отхода получался хлорид аммония, который можно использовать как удобрение.
И процесс Сольвея, и процесс Хоу требуют больших затрат энергии — мел надо нагревом разложить на известь и углекислый газ. Так получаются огромные выбросы углекислого газа — чуть больше одной тонны на тонну соды. Поскольку на оба процесса приходится соответственно 50 и 20% мирового содового производства, в сумме эта технология дает 43 млн тонн углекислого газа. Вклад обжига троны в глобальное потепление меньше — 0,75 тонны газа на тонну соды, что приводит к выбросам еще 13 млн тонн СО2. А вот четвертый способ — обработка углекислым газом минеральной воды, содержащей карбонат натрия, — оказывается самым чистым: всего 0,45 тонны газа на тонну соды, или в сумме 4 млн тонн.
В чем смысл этого процесса? В том, что в молекуле карбоната два иона натрия. При обработке его раствора углекислым газом из каждой образуются две молекулы гидрокарбоната, NaHCO3. При последующей кальцификации каждая из них снова станет молекулой карбоната. В результате выбросы углекислого газа удается утилизировать. Именно такое производство развернуто в Калифорнии, то есть производство совсем не грязное, углерод-нейтральное. Оказывается, при известной смекалке и политической воле решать проблему утилизации углекислого газа можно, а политической воли у Калифорнии изрядно — к 2045 году ее экономика должна стать полностью углерод-нейтральной и оказаться лидером в борьбе с глобальным потеплением не на словах, а на деле.
В процессы Хоу и Сольвея ввести изъятый из атмосферы или печной трубы углекислый газ пока не удается. А жаль, ведь при этом решилось бы несколько экологических задач: сохранение уникальных памятников природы — меловых гор, экономия топлива за счет отказа от термического разложения карбоната кальция и прямое сокращение содержания парникового газа в атмосфере. Время от времени появляются сообщения, что, мол, есть планы модернизировать какое-то содовое производство и хотя бы утилизировать газы их собственных энергетических установок, но в практику эти планы не воплощаются. Видимо, для успеха нужно сочетание двух условий: высокие штрафы за выбросы углекислого газа и высокая цена топлива, что стимулировало бы его экономию. Как видно, время таких условий еще не пришло.
Почему гидроксид натрия назвали каустической содой? Слово «каустик» (caustic) по-английски означает «едкий», а поначалу гидроксид натрия, он же едкий натр или попросту щелочь, получали каустификацией соды, когда ее смешивали с едкой, то есть гашеной, известью — гидроксидом кальция. Образующийся при этом карбонат кальция выпадал в осадок, а гидроксид натрия оставался в растворе. Термическое разложение гидрокаброната натрия — другой старинный способ получения едкого натра. Сейчас же его промышленно получают электролизом раствора хлорида натрия, и тут скорее хлор оказывается целевым продуктом, а щелочь — отходом производства. Объем этого отхода огромен — 60 млн тонн в год, и весь идет в дело. Поскольку производство щелочи зависит не от спроса на рынке, но от потребности в хлоре, при колебаниях последнего либо сода замещает недостающую щелочь, либо, наоборот, лишняя щелочь вытесняет с рынка соду. Такая замена возможна в тех отраслях, где щелочь применяют для нейтрализации кислоты, — в бумажном производстве или при водоподготовке. Основное же использование щелочь находит при производстве целлюлозы — она не только нейтрализует применяющиеся там кислоты, но и прекрасно растворяет лигнин, а также для промывки бокситов перед передачей их в алюминиевое производство: на это идет 17% и 11% щелочи соответственно. Вообще же щелочь находит применение в бесчисленном числе производственных процессов, будучи таким же столпом технологической цивилизации, как и сода. Среди экзотических применений едкого натра — быстрое уничтожение преступниками трупов для сокрытия улик. Сейчас эту методику, идущую из Италии, в промышленных масштабах используют мексиканские наркокартели в ходе идущей с начала XXI века междуусобной войне. Порой участников этих преступлений удается изобличить; например, в 2009 году вся Мексика следила за процессом над Сантьяго Месой Лопесом по кличке Эль Посолеро, то есть «Изготовитель тушенки»: он за девять лет уничтожил щелочью более трехсот тел.
Как получают металлический натрий? Промышленное производство натрия начинается с открытия Анри Девилем в 1850-х годах процесса пережигания соды с углем — карбонатный остаток становится углекислым газом и улетает, а металлический натрий остается. Натрий был нужен Девилю не сам по себе — он служил реагентом при получении алюминия из двойного хлорида натрия-алюминия. Сейчас натрий делают электролизом расплава либо гидроксида, либо хлорида натрия, то есть как его и открыл в 1807 году Гемфри Деви, который провел электролиз щелочи. Используют его во множестве химических процессов, один из самых известных — получение синтетического каучука, где натрий служит катализатором.
Зачем металлический натрий ядерщикам? Он им нужен как теплоноситель для реакторов. Натрий хорош тем, что у него низкая температура плавления в сочетании с высокой температурой кипения: жидким натрием можно переносить огромные количества тепла от реактора к внешнему охлаждающему контуру и не сильно опасаться, что жидкость перегреется и закипит. А кроме того, у натрия низкое сечение захвата нейтронов; натрий, омывающий тепловыделяющие сборки из атомного топлива, не мешает протеканию цепной реакции. По этому параметру его опережают только свинец с висмутом. Из свинцово-висмутового сплава изготавливают жидкий теплоноситель для подводных лодок, а натрий применяют для реакторов на быстрых нейтронах. Первый такой реактор БОР-60 запустили в Димитровграде в 1969 году, он служил прототипом реактора для АЭС малой мощности и для исследований, вывод этого реактора из эксплуатации намечен на 2020 год.
Своеобразным шедевром технической мысли стал запущенный в 80-м году на Белоярской АЭС реактор БН-600 (название означает «быстрый натриевый»), на котором удалось выявить, а затем устранить слабые места конструкции таких реакторов. Для его оснащения создали специальное производство металлического натрия реакторной чистоты — в охлаждающий контур потребовалось загрузить две тысячи тонн этого металла. С учетом опыта БН-600 спроектировали самый совершенный на сегодня реактор на быстрых нейтронах — БН-800, введенный в эксплуатацию в 2016 году на Белоярской АЭС; в нем также использован натриевый теплоноситель. Так натриевый теплоноситель стал единственным, который опробован в реальной работе на реакторах такого типа.
Как натрий поможет разлагать воду? В принципе, если бросить металлический натрий в воду, то он ее разложит, образуя едкий натр и водород. Причем сделает это столь энергично, что может взорваться. Такое разложение воды никому не нужно, поскольку натрий в этом процессе израсходуется и никакого выигрыша в энергии не получится, а ведь воду предполагается разлагать для того, чтоб полученным водородом заменить ископаемое топливо. Есть мнение, что эта идея чудовищна, потому что вода и так в дефиците. Это мнение ошибочно — вода снова получается при сгорании водородного топлива и возвращается в естественный круговорот влаги.
Вот для получения водорода без сжигания ископаемого топлива и может послужить одно замечательное соединение — танталат натрия, NaTaO3; оно разрушает воду под действием солнечного света, а само при этом не расходуется. Получается удивительная картина: серый порошок насыпают на дно стеклянного стакана, наливают воду, ставят на свет — и все: вода наполняется пузырьками водорода и кислорода. Никаких дополнительных затрат энергии и материалов: для получения водородного топлива надо просто добавлять воду! Полученный водород можно не только сжечь, но и использовать для получения органических веществ.
Первыми способность танталата к разложению воды заметили в 1997 году («Chemical Letters») Кудо Акихики и Като Хидеки из Токийского университета науки, правда, сделали они это с другим соединением тантала — K3Ta3Si2O13. Однако спустя десять лет основным объектом внимания стал танталат натрия. В лидеры его вывели те же самые Кудо и Като: они изучали фотолюминесценцию танталатов натрия, легированных редкоземельными элементами, и заметили, что помимо люминесценции таким соединениям присуща и способность разлагать воду. Лидером в их опытах оказался танталат натрия, легированный лантаном и смешанный с небольшим количеством оксида никеля — именно на нем зарождается молекула водорода. В 2000 году при облучении ультрафиолетом от ртутной лампы грамм танталата давал 5,9 ммоль водорода в час, а спустя три года — уже 19,5.
Более того, в 2010 году Терамура Кентаро с коллегами из университета Киото («Applied Catalysis B: Environmental») обнаружили, что танталат натрия не только разлагает воду. Если пропускать через реактор углекислый газ, то образующийся водород опять-таки при помощи танталата станет восстанавливать углекислый газ до угарного. То есть можно в схожих танталато-водных установках получать синтез-газ: смесь водорода и угарного газа; как раз его и применяют для промышленного синтеза различной органики. Вся эта технология может оказаться востребованной на Земле — для синтеза того же топлива из углекислого газа и воды (случится это после запрета ископаемого топлива) — и совершенно точно пригодится при освоении космического пространства и планет, в частности Марса: на нем предостаточно и ультрафиолета, и углекислого газа, а воду можно получать как из льда полярных шапок, так и из подповерхностных залежей вечной мерзлоты.
Сейчас задача исследователей — с помощью легирования изменить кристаллическую решетку танталата натрия и увеличить выход водорода, причем под действием не только ультрафиолетовой части, но всего солнечного спектра. Путь более-менее понятен — нужно как можно сильнее исказить эту решетку, максимально сдвинув слагающие ее атомы из своих идеальных положений. На роль такого исказителя претендует стронций, который может занимать место как натрия, так и тантала, но пока идеальное соотношение элементов не найдено. Пока что в базе научных публикаций по проблеме, собираемой Ониси Хироси из университета Рокки-даи в Кобе («ChemSusChem», 2019, 12), накопилось почти две сотни работ — исследования танталатного катализатора разложения воды находятся на переднем фронте современной науки, по крайней мере, японской.
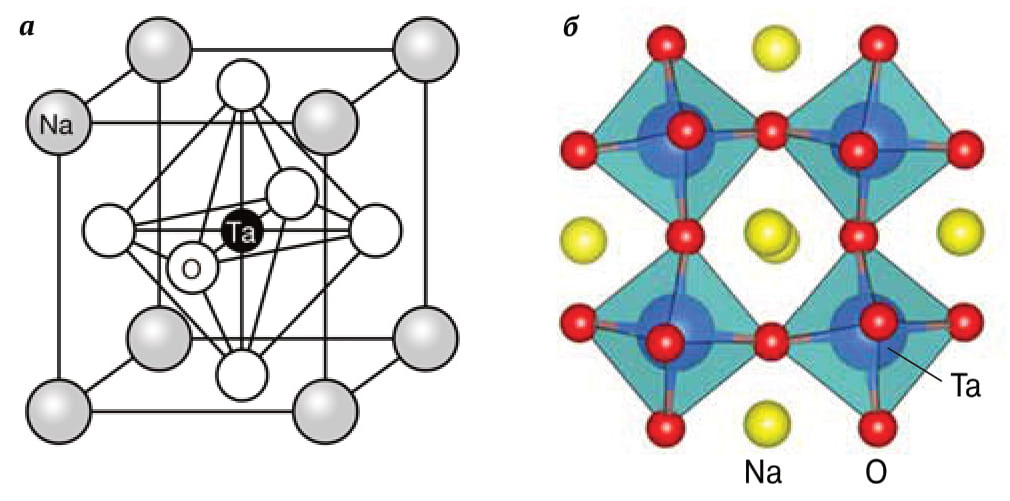 |
| В идеале решетка танталата натрия соответствует решетке перовскита (а). Однако для того, чтобы хорошо разлагать воду, атомы натрия надо сместить из идеальных положений (б) |
Что такое натриевая батарейка? Это наиболее вероятная замена литиевому металл-ионному аккумулятору. Над проблемой натриевой батарейки работает множество материаловедов примерно с 2015 года, когда стало ясно, что потенциал роста для литиевых батарей исчерпан. Проблема натриевых аккумуляторов в том, что электрический потенциал натрия выше, чем у лития, потому требуется гораздо более высокое насыщение электродов его ионами. Мало того что это не так уж просто сделать, так еще и размер иона натрия гораздо больше, чем у иона лития. Поэтому электрод, где накапливаются ионы натрия, быстро разрушается. Идеальные материалы для электродов и разделяющей их мембраны пока не найдены, хотя исследователи испробовали огромное число комбинаций — и различный углерод, и фосфаты, и оксидные системы, и много чего еще.
Не исключено, что, как это не раз бывало в истории техники, к успеху приведет не желание отделаться косметическими изменениями известной конструкции, а принципиально новое решение. Например, многие исследователи думают над содовым элементом, где попутно с запасанием энергии удается прятать углекислый газ и получать финансирование еще и от фондов борьбы с потеплением. В содовом элементе при разрядке металлический натрий взаимодействует с углекислым газом и превращается в карбонат натрия и атомарный углерод. А при зарядке под действием электрического тока карбонат разлагается с образованием металлического натрия на аноде и углекислого газа на катоде. То есть внутри элемента фактически протекает процесс Девиля.
Вот как выглядит свежий пример содового элемента, созданного исследователями из группы профессора Чэнь Цзюня из Нанкинского университета («Research», 2018: 6914626). Работая над такой батарейкой уже не первый год, они решили отказаться от электрода из металлического натрия — с ним никак не удается избавиться от дендритов, которые закорачивают батарейку. Вместо этого взяли углеродные нанотрубки и инкрустировали их частицами соды. А второй электрод сделали из алюминиевой фольги, на которую нанесли пористый слой из сажи и органики. Всю батарейку поместили в герметичную коробку, заполненную углекислым газом. Такая конструкция дала плотность энергии 183 Вт⋅ч на кг материала, что, как отмечает профессор Чэнь, несколько больше, чем у имеющихся на рынке литиевых батареек, — 150–180 Вт⋅ч на кг, стабильную работу при многократных циклах зарядки-разрядки и отсутствие натриевых дендритов. Авторы работы считают, что придуманная ими батарейка вполне может превратиться в практически важные дешевые устройства хранения электрической энергии.
 |
| Так выглядит содовая батарейка, которую в Нанкинском университете создал Сунь Цзяньчао и его коллеги из группы профессора Чэнь Цзюня («Research», 2018 ) |
Какова роль натрия в формировании минеральных вод? В большинстве случаев именно натрий обеспечивает их минерализацию своим гидрокарбонатом, сульфатом или хлоридом. Тот факт, что минеральная вода обладает целебными свойствами, человечество узнало в незапамятные времена, а научный подход к водолечению насчитывает уже два столетия, на эту тему написано огромное число книг и статей, поэтому остановимся на одном эпизоде: лечении зловреднейшего недуга нашего времени — синдрома рефлюксного экзофагита, или попросту изжоги. При этом недуге в силу того, что из-за каких-то причин скорость перемещения пищи снижается (тибетские врачи образно объясняют так: в желудке не хватает жара, чтоб сварить пищу), происходит комплексное расстройство всего пищеварения, а печальный результат — постоянное попадание желудочного сока в пищевод, который и начинает в этом соке перевариваться. Хороших способов борьбы с ним нет — если такая беда случилась, пациент пожизненно должен принимать препараты, снижающие кислотность желудочного сока. О размере бедствия свидетельствует медицинская статистика: в развитых странах клинические проявления болезни фиксируют у 20—40%, в РФ на изжогу жалуется 40—60%, а изменения в пищеводе находят у 12—16% взрослого населения. В одних только США на главное лекарство — ингибиторы протонной помпы — пациенты тратят более 13 млрд долларов в год.
Однако в старину изжогу лечили содой, а вода с гидрокарбонатом натрия, в сущности, это тот же раствор соды. Неужели содовая вода не может справиться с недугом? Отечественные курортологи поставили не одно исследование на разных видах минеральной воды. Вывод: таким пациентам после лечения медикаментами обязательно надо ехать на курорты, где есть источники с щелочными мало- или среднеминерализованными водами, желательно натриево-магниевыми или кальциево-магниевыми — Ессентуки, Ижевск, Кашин и другие («Физиотерапия, бальнеология и реабилитация», 2013, 5).
Американцы же из Нью-Йоркского медицинского колледжа подошли к проблеме с другой стороны. Они не стали возить пациентов на курорты, а договорились с ними об изменении образа жизни — переходе на средиземноморскую диету с большим количеством овощей и заменой всех напитков щелочной водой («JAMA Otolaryngology-Head Neck Surgury», 2017, 10). У таких пациентов индекс синдрома снизился на 63%, а вот применение стандартной терапии в контроле оказалось менее успешным — 54%. К сожалению, все эти исследования ставят на небольших группах — в пределах нескольких десятков, в лучшем случае сотен участников, хотя последнее, с изменением диеты, можно было бы провести и весьма широко. А что же это за щелочные минеральные воды? Нам из их числа хорошо известны «Нарзан», «Ессентуки-4» или «Славяновская».
Чем соль похожа на табак? На основании огромного числа исследований Всемирная организация здравоохранения и многие национальные медицинские ассоциации пришли к твердому выводу: соль для общества такой же яд, как и табак. Причем в соли главным злодеем оказывается не хлор, а именно натрий. Соображения примерно такие. Натрий — важнейшее вещество крови и других биологических жидкостей; его концентрация определяет физическую химию организма, которая, в свою очередь, руководит всеми биологическими процессами. Если натрия излишне много, организм начинает реагировать — запасать в организме воду, и результатом такой реакции становится рост кровяного давления, гипертония. Когда она переходит в хроническую стадию, человек страдает, страдает и его семья. Из-за плохого самочувствия он не может полноценно работать, а медикам приходится его лечить. И сама гипертония, и лечение от нее приводят к развитию сердечно-сосудистых заболеваний, например к охрупчиванию сосудов. В общем, если считать соль причиной гипертонии, то смертность от нее превышает смертность от табака: 10 млн человек против 8.
Свежее исследование факторов диетического риска для здоровья, проведенное Университетом штата Вашингтон на деньги фонда Билла и Мелинды Гейтс, позволяет диетологам утверждать: ежегодно соль вызывает 3 млн преждевременных смертей и 70 млн человеко-лет, отягощенных недомоганиями («Lancet», 2019, 393). Кстати, недостаток в питании цельных зерен или фруктов приводит к аналогичным результатам (3 и 82 или 2 и 65 млн смертей и человеко-лет соответственно). Экономический ущерб от сердечно-сосудистых заболеваний, по данным ВОЗ, составляет под 4 трлн долларов в год. И этого всего, видимо, можно избежать простейшими мерами!
Исследования на больших группах людей показывают, что даже небольшое снижение потребления соли — на один грамм натрия в день — значительно уменьшает тяжесть гипертонии, число случаев сердечно-сосудистых заболеваний падает на 30%. То есть всего-то надо класть в еду не две-три щепотки соли, а одну. И тогда повысится глобальный уровень здоровья и, стало быть, счастья людей, снизятся расходы на здравоохранение и экономические потери от выбытия из производства опытного работника. Поэтому ВОЗ и считает, что борьба с солью имеет такое же значение, как и бескомпромиссная борьба с курением табака.
См. также:
