Редакторы жизни
Лауреатам премии по химии 2020 года смокинги не понадобятся. Не потому, что из-за карантина отменили традиционный нобелевский дресс-код, — церемония пройдет, хотя и онлайн. Просто оба лауреата будут в платьях. Премию получат Эмманюэль Шарпантье (Отделение Макса Планка по науке о патогенах, Берлин, Германия) и Дженнифер Дудна (Калифорнийский университет, Беркли, США) за разработку метода редактирования генома. Ожидаемая, немного скандальная и очень важная премия. Если б не коронавирус, мы бы говорили только о ней.

|
|
Эмманюэль Шарпантье и Дженнифер Дудна |
Самая древняя иммунная система
Эмманюэль Шарпантье и Дженнифер Дудна награждены за создание одного из самых совершенных на сегодня инструментов генной технологии: «генных ножниц» CRISPR-Cas9. Молекулярный механизм, который с минимальными затратами времени и денег вносит направленное изменение в геном растения, животного или бактерии, полностью преобразовал экспериментальную биологию. Более того, за восемь лет своего существования он нашел многочисленные практические применения: от создания новых сортов культурных растений до терапии рака, наследственных заболеваний и разработки тест-систем для выявления опасных патогенов.
Наука прекрасна предопределенностью и непредсказуемостью. Вряд ли кто-то из участниц этой истории думал, что исследование пиогенного стрептококка приведет к чему-то большему, чем новое антимикробное средство. (И уж тем более об этом не думала другая команда ученых, когда компания «Danisco» попросила их разобраться, что происходит с их молочными продуктами.) Но то, что так случилось, — закономерно. Значительная часть молекулярной биологии держится на молекулярных машинках, заимствованных у братьев наших меньших. У микроорганизмов мы взяли ферменты, разрезающие ДНК в определенных участках, ферменты, которые снимают копии с нуклеиновых кислот,— не будь у нас обратной транскриптазы и ДНК-полимеразы, как бы мы ставили тесты на коронавирус и как бы вообще работали с ДНК? Оказалось, у бактерий и архей есть еще более удивительные гаджеты.
Эмманюэль Шарпантье на вопросы о «случайности» отвечает цитатой из Пастера: «Удача благоволит подготовленному уму». Считая парижский Института Пастера, где она проходила аспирантуру, Шарпантье работала в десяти научных организациях пяти стран, легко переезжая туда, где было проще достичь цели.
В 2002 году, когда Эмманюэль Шарпантье стала руководителем научной группы в Венском университете, она изучала особо злостного врага человечества — пиогенного стрептококка. Каждый год он инфицирует миллионы людей, и если тонзиллит или импетиго легко излечимы, то сепсис может стать приговором. Шарпантье продолжала его исследовать и в 2009 году, когда переехала в Университет Умео на севере Швеции — долгой полярной ночью, в тишине и спокойствии ей хорошо работалось. Она изучала регуляторные РНК стрептококка — малые молекулы, которые, в отличие от матричных РНК, не кодируют белков, а регулируют функции других генов. Среди них она вместе с коллегами из Германии обнаружила РНК, комплементарную небольшому участку CRISPR в геноме бактерии.
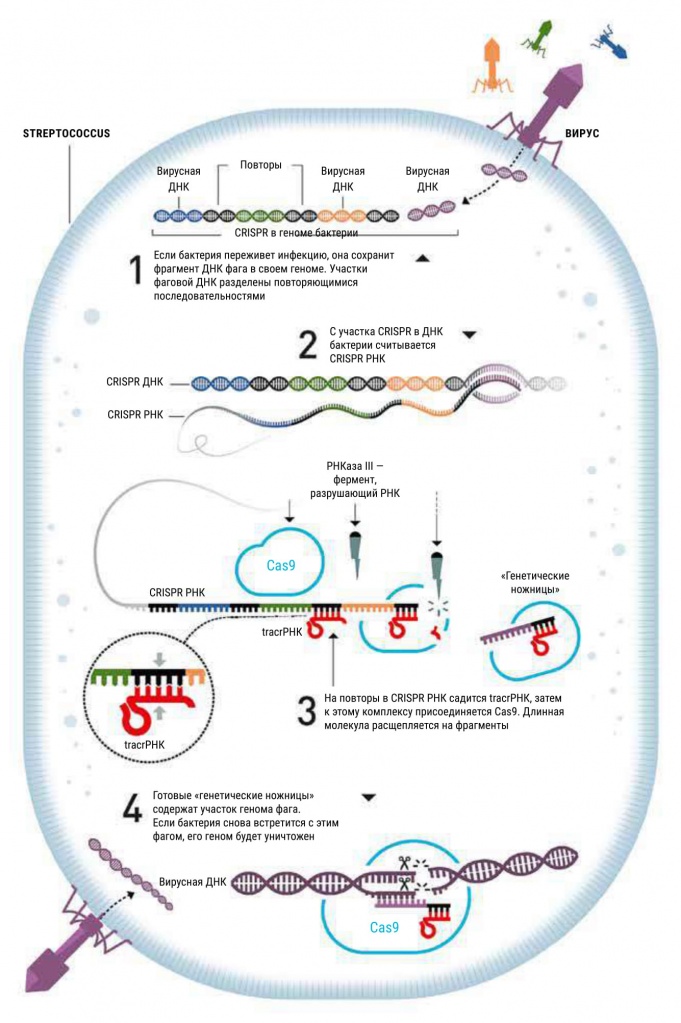
Что такое CRISPR? Характерная последовательность, обнаруженная еще в 80-е годы в геноме кишечной палочки, а потом в геноме солелюбивой археи Haloferax mediterranei, а потом в геномах еще множества бактерий и архей («Химия и жизнь», 2014, 7). CRIPR — clustered regularly interspaced short palindromic repeats, «кластеризованные короткие палиндромные повторы с регулярными промежутками». Проще говоря, этот участок ДНК содержит повторяющиеся «слова», которые перемежаются неповторяющимися. Совсем как в той клинописной надписи из Персеполя, о расшифровке которой писал Зенон Косидовский в книге «Когда солнце было богом», — той, где одинаковые группы знаков, замеченные сообразительным человеком, переводились как «царь» и «сын царя», а неповторяющиеся между ними оказались именами царей.
Только CRISPR-последовательность в геноме микроорганизма — это не династический список, а перечень побежденных, зал трофеев. Повторяющееся «слово», скорее всего, можно перевести на человеческие языки как «убить»: «Убить А, убить Б, убить С…». Разнообразные фрагменты между одинаковыми — это, как выяснилось в начале 2000-х годов, участки геномов бактериофагов, вирусов бактерий. Возникло предположение, что бактерия сохраняет кусочки своих врагов «на память» о пережитых инфекциях и что эти «сувениры» в геноме помогают ей побеждать вирус при повторной встрече с ним. Иными словами, открыта архаичная иммунная система безъядерных организмов!
 |
|
Иммунная система стрептококка: CRISPR-Cas9 Бактериофаг внедряет в клетку свою вредоносную ДНК
© Johan Jarnestad/The Royal Swedish Academy of Sciences
|
Одна РНК и один белок
Как это работает, все еще было непонятно. Но сразу возникло предположение, что через механизм РНК-интерференции: наверное, с этих участков считываются РНК-копии, связываются с геномом фага и как-то способствуют его уничтожению. В целом эта гипотеза оказалась верной. CRISPR-система нужна бактериям и археям не для редактирования, а для вычеркивания — удаления вражеских комментариев.
Действительно, CRISPR-участок в геномах бактерий кодирует длинную молекулу РНК (пре-crРНК), которая затем расщепляется на малые CRISPR-РНК (crРНК), каждая с идентификатором одного врага. Очевидно, это crРНК наводит орудие на мишень. А орудием оказались уже известные белки, расщепляющие ДНК, которые теперь получили название Cas (CRISPR-associated).
Дженнифер Дудна в 2006 году уже возглавляла исследовательскую группу в Университете Калифорнии (Беркли) и как раз занималась РНК-интерференцией. У нее уже была репутация успешного исследователя, с чутьем на интересные направления, и CRISPR-Cas заинтересовал ее сразу. Группа Дудны была в числе тех, кому удалось установить, что Cas-белки тоже режут ДНК, как и другие ферменты-нуклеазы, на которые они похожи. Дудна с коллегами исследовала CRISPR-Cas-систему класса I, более сложно устроенную. А Шарпантье, которая в другом полушарии изучала стрептококк, —
CRISPR-Cas-систему класса II, более простую, где использовался для атаки на мишень единственный Cas-белок, Cas9.
Так вот, молекула РНК, открытая Шарпантье с коллегами, — trans-activating crispr RNA (tracrРНК) — была комплементарна повторяющимся участкам последовательности CRISPR, а также соответствующим участкам пре-crРНК, которые с нее считывались. Эта молекула необходима для превращения пре-crРНК в активную форму, то есть для разрезания длинного списка на отдельные «черные метки».
Статью о tracrРНК Шарпантье опубликовала в 2011 году. Она понимала, что ей, микробиологу, для дальнейших исследований нужно скооперироваться с биохимиком. И когда ее пригласили на конференцию в Пуэрто-Рико сделать сообщение об открытии нового фрагмента CRISPR-механизма, Эмманюэль Шарпантье познакомилась с Дженнифер Дудной, и они запланировали совместную работу.
Изначально они предполагали, что crРНК нужна для идентификации фаговой ДНК, а Cas9 — для ее разрезания и больше ничего не требуется. Однако когда оба компонента добавили к ДНК-мишени, мишень осталась неразрезанной. Неудачи продолжались до тех пор, пока исследователи не догадались добавить еще и tracrРНК. Оказалось, она нужна не только для созревания CRISPR-РНК, но и для самого акта разрезания мишени. И все получилось. Внутри отвратительного пиогенного стрептококка обнаружился прекрасный, остроумный и совершенный механизм защиты от вирусов.
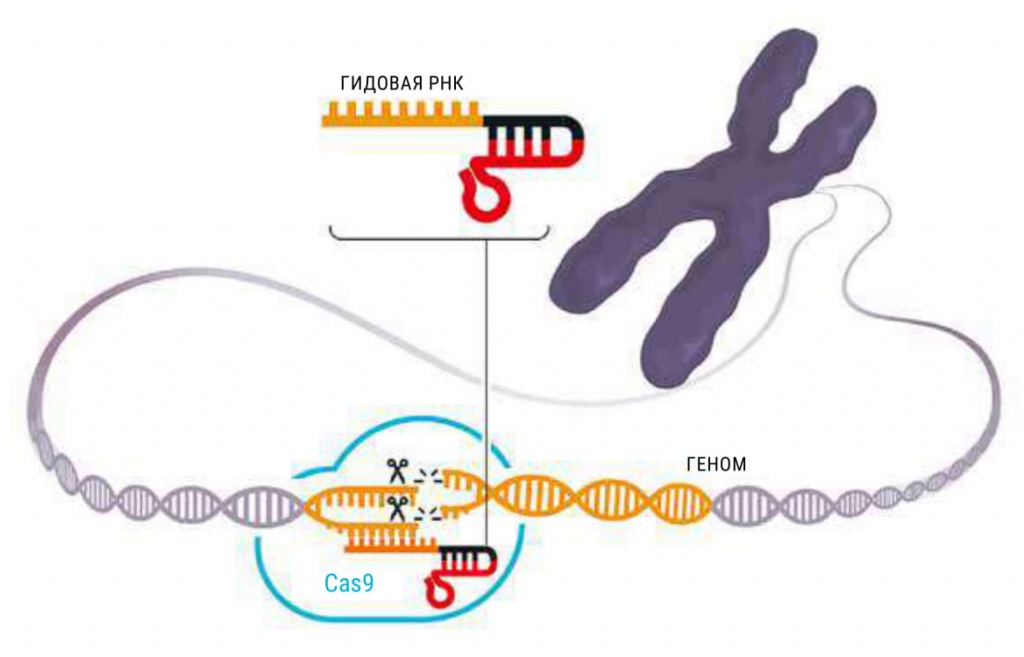
Дудна и Шарпантье придумали еще две отличные вещи. Во-первых, они объединили в одну молекулу зрелую crРНК и tracrRNA, назвав эту молекулу «гидовой РНК» (guide RNA). Чем меньше деталей, тем надежнее механизм. А во-вторых, они проверили, что произойдет, если изменить последовательность этой РНК, нацелив ее вместо фагового генома на произвольный участок ДНК. Просто взяли ген, который имелся в холодильнике у Дудны в лаборатории, и обнаружили, что могут точно разрезать его в заранее выбранных точках. Клетка сама склеит разрезы, в гене появятся мутации. Добро пожаловать в новый мир!
Дудна, Шарпантье и соавторы опубликовали этот результат в 2012 году. Таким образом, до Нобелевской премии прошло восемь лет — пожалуй, рекорд быстроты для молекулярной биологии. И Кэри Муллис с полимеразной цепной реакцией, и даже Крик и Уотсон с двойной спиралью ждали дольше.
 |
|
CRISPR-Cas9 — конструкция для редактирования генома
Чтобы получить «ножницы» для разрезания определенного участка генома, ученые создают гидовую РНК, комплементарную участку-мишени. С гидовой РНК образует комплекс нуклеаза Cas9, которая делает разрез
|
Эксперимент, медицина, диагностика
За эти восемь лет изменилось все. CRISPR стал любимым экспериментальным методом для биологов всех стран. Для ясности, CRISPR конечно же не был «первым в мире» способом редактирования генома. Но те, что существовали до него, были намного более трудоемкими: для разрезания определенной последовательности ДНК надо было создавать специальные белки. А это куда сложнее и дороже, чем получить молекулу РНК, комплементарную участку-мишени. Чтобы понять, насколько это облегчило работу экспериментатора, сравните бумажный англо-русский словарь с гугл-переводчиком. Эти более ранние методы еще не исчезли со сцены; как и бумажный словарь, в некоторых ситуациях они незаменимы. Но теперь любой аспирант, который задумается, что будет, если подопытному организму выключить тот или иной ген, может удовлетворить свое любопытство. А научная группа, не слишком стесненная в средствах, может по очереди повыключать десятки тысяч генов в человеческой клетке, чтобы понять, продукты каких из них помогают вирусу в нее проникнуть.
Вывести ген из строя с помощью CRISPR — простейшая операция: система редактирования делает разрез, внутренние клеточные системы ремонта ДНК склеивают края, но неточно. Исправить вредную мутацию, вставить фрагмент вместо вырезанного несколько сложнее, но и это возможно.
Возникло множество модификаций метода. Можно превратить ножницы в прищепку — использовать «тупую» Cas-нуклеазу, которая не разрежет ДНК, а только доставит в нужное место регулятор, изменяющий активность гена. Можно, не разрезая саму нить ДНК, химически изменить один нуклеотид в цепочке — сделать замену одной буквы на другую в определенном месте. Такие CRISPR-системы называются «редакторами оснований».
CRISPR используют для получения новых сортов растений — тема очень важная на пороге глобального потепления, ей занимается и сама Дженнифер Дудна. Интересный факт: редактирование генов, по сути, не является получением ГМО, поэтому существующие законы против ГМО на отредактированные организмы не распространяются.
Уже идут клинические исследования CRISPR-терапии наследственных заболеваний — бета-талассемии, серповидноклеточной анемии, заболеваний зрения. Весьма перспективны методы иммунотерапии онкозаболеваний: отредактированные клетки иммунной системы лучше «понимают», как бороться с болезнью («Химия и жизнь», 2016, 12). Это пока методы ex vivo — редактирование клеток вне организма с последующим возвращением в организм. Следующим этапом станет доставка редактирующей конструкции в специальном вирусном векторе прямо в ткани организма, ремонт на месте.
Другое дело — редактирование клеток зародышевой линии, то есть женских и мужских половых клеток, оплодотворенных яйцеклеток и любых клеток, которые могут дать начало целому организму. Скандал двухлетней давности с доктором Хэ Цзянькуем, который объявил о рождении двух девочек с исправлениями в геноме, якобы защищающими от ВИЧ-инфекции, еще не забылся. Кстати, Дженнифер Дудна и другие пионеры CRISPR решительно осудили экспериментатора. Ни один компетентный специалист, насколько нам известно, не считает возможным такое редактирование на нынешнем уровне развития технологии. Пока — только соматические клетки, то есть те, которые так или иначе закончат свою жизнь в организме одного человека.
CRISPR можно использовать и не для редактирования. Мы писали о тест-системах, созданных на его основе: CRISPR-Cas расщепляет не только молекулу-мишень, но и так называемую молекулу-репортер, при этом появляется флуоресценция, и по ней можно судить, например, о присутствии в образце генома вируса.
Кто не получил CRISPR-премию?
Как только были объявлены имена лауреатов, началось традиционное постнобелевское развлечение: перечисление исследователей, причастных к нобелевскому открытию и не получивших награды, «потому что они не женщины», «потому что они не так распиарены», «потому что Нобелевский комитет их не любит»...
Идею о том, что CRISPR — иммунная система прокариот, высказали в начале 2000-х сразу несколько научных групп. В частности, Cas-белки (которые тогда еще не назывались CRISPR-ассоциированными) группа Евгения Кунина в Национальном центре биотехнологической информации США изучала еще в 1990-е. А в 2006 году команда Кунина опубликовала статью, где отмечала, что мнение об участии белков Cas в ремонте ДНК оказалось неверным: они часть «иммунной системы» бактерий. Их вклад в понимание бактериального иммунитета огромен. Но аналогичные предположения высказывали испанец Франсиско Мохика, открывший CRISPR у археи Haloferax mediterranei, и француз Филипп Хорват, специалист по микробиологии пищевых, продуктов, работающий в «Rhodia Food» — компании, позднее приобретенной «Danisco», а потом «DuPont». Хорват с коллегами изучали стойкость бактериальных заквасок для сыров и мороженого и сумели показать, что инактивация гена Cas, как и потеря участков CRISPR, делала бактерию уязвимой к атакам фагов. В 2006 году они уже вывели суперустойчивые к фагам штаммы термофильного стрептококка с длинными участками CRISPR. (Вот вам и презренная пищевая биотехнология: прикладники, специалисты по йогурту, встали в один ряд с крупными учеными и нобелевскими лауреатами.)
Очень обидная история с литовскими биохимиками. Еще в 2007 году Виргиниюс Шикшнис из Вильнюсского университета и его коллеги начали заниматься системой CRISPR. В 2011-м они перенесли функционирующую CRISPR-систему II типа из стрептококка в кишечную палочку. Тем самым было доказано, что для разрезания мишени необходимы и достаточны три компонента: crРНК–tracrРНК–Cas9.
Шарпантье и Дудна с коллегами опубликовали свою работу в августе 2012 года. В сентябре того же года вышла статья Шикшниса с соавторами в журнале PNAS. Но они могли быть первыми, поскольку ранее посылали свою статью в «Cell», однако ее отклонили без рассмотрения. Тем не менее именно Дудне и Шарпантье принадлежит приоритет в создании гидовой РНК из двух отдельных молекул.
А что же Фэн Чжан из Института Бродов, оппонент Дудны и Шарпантье в судах? Группа под руководством Фэна Чжана опубликовалась позже — в феврале 2013 года. Зато в их работе технология была испытана на клетках млекопитающих — человека и мыши. Ясно было, что эти патенты станут ключевыми для практических медицинских применений.
В апреле 2014 года Институт Бродов получил первый из нескольких патентов на использование CRISPR в клетках млекопитающих. С тех пор продолжается тяжба между Дудной, Шарпантье и их учреждениями, с одной стороны (эту сторону в судебных документах сокращенно называют CVC — California, Vienna, Charpentier), Фэном Чжаном и Институтом Бродов — с другой. Перевес на стороне Института Бродов («Химия и жизнь», 2016, 8). Зато Дудна и Шарпантье получают Нобелевскую премию, и права на технологию в Европе (а не в США), по-видимому, также остаются у них.
Пионеры CRISPR использовали свою технологию для создания точных и быстрых диагностических тест-систем, выявляющих коронавирус. Компании, получившие лицензии на технологии от Чжана и от Дудны, идут ноздря в ноздрю — и те и другие получили разрешение на использование своих тестов в экстренной ситуации.
Открытие CRISPR и технологии на ее основе — заслуга множества людей, и можно спорить о том, чей вклад наиболее весомый. Но главное, что Нобелевская премия присуждена за редактирование генов. Теперь это официально: редактирование генов — технология, созданная на благо человечества. А как погасить энтузиазм возможных последователей Хэ Цзянькуя, придумаем.
