Необходимый и недоступный

Азот — это вечный источник танталовых мук человечества, вечные терзания голода среди роскошного изобилия.
Мартин Д. Камен, американский биохимик
Вероятно, нет другого химического элемента, который доставил бы человечеству столько хлопот. Запасы молекулярного азота N2 огромны — это основной компонент воздуха, его содержание в земной атмосфере превышает 78% по объему, или 4·1015 т. Над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 10 млн тонн аммиака. Но людям нужен не молекулярный азот, а химически связанный, в составе различных соединений. Над этой задачей химики бьются вот уже второй век.
Ошибка и правота Юстуса Либиха
Человечество далеко не сразу поняло, как ему нужен азот и в чем его польза. В середине XIX века крупнейшую в Европе научную школу химиков возглавлял выдающийся немецкий ученый Юстус Либих. В число его учеников входили и видные российские химики — А.А. Воскресенский, Н.Н. Зинин и др. Основным направлением его исследований было получение и изучение новых химических соединений: он впервые описал хлороформ (1831), уксусный альдегид (1835), открыл молочную и другие карбоновые кислоты. Помимо этого, он исследовал физиологические процессы, например предложил химическую теорию брожения и гниения. Одна из его работ, доставившая ему много неприятностей, оказалась чрезвычайно важной.
Анализируя золу сожженных растений, Либих установил, что в ее состав входят калий, фосфор, кальций и другие элементы. Рассуждения его были просты и логичны: единственный источник этих элементов для растений — почва. А значит, после многократно собранных урожаев она постепенно обедняется, и нужные элементы необходимо добавлять в почву для увеличения ее плодородия. Основные взгляды он изложил в книге «Органическая химия в приложении к земледелию и физиологии» (1840).
Истины, которые нам теперь кажутся совершенно очевидными, вызвали в то время резкий протест и возмущение у многих ученых. «Это самая бесстыдная книга из всех, которые когда-либо попадали мне в руки», — писал о ней профессор ботаники Тюбингенского университета Гуго фон Моль. «Совершенно бессмысленная книга», — вторил ему известный немецкий писатель Фриц Рейтер, занимавшийся некоторое время сельским хозяйством. Немецкие газеты публиковали оскорбительные письма и карикатуры на Либиха и на его теорию минерального питания растений. Ситуация осложнилась тем, что во многих случаях калийно-фосфатные удобрения, предложенные Либихом, не показали себя эффективными.
Они не содержали еще одного очень важного элемента азота. Вначале Либих полагал, что азот растения усваивают из воздуха так же, как кислород и углерод (в виде СО2).
У Либиха хватило мужества признать и исправить свою ошибку, посему история химии ко всем его многочисленным заслугам причисляет также создание новой науки — агрохимии. Постепенно его взгляды стали общепризнанными, и вскоре это привело к появлению заводов по производству минеральных удобрений.
Почему леса растут без удобрений
Интересно, что Либих был не так уж и неправ: некоторые растения (например, горох, клевер, соя) способны усваивать атмосферный азот с помощью микроорганизмов, которые живут в особых клубеньках на их корнях. Такие бактерии, называемые азотфиксирующими, умеют в мягких условиях, при обычных температуре и давлении превращать атмосферный азот в химические соединения. Существуют также азотфиксирующие цианобактерии, или сине-зеленые водоросли (главные «виновники» цветения воды).
Второй, не менее важный процесс связывания атмосферного азота — это электрические разряды в молниях. Каждую секунду на нашей планете в землю ударяет до 100 молний. При высоких температурах (в канале молнии температура достигает 20 000°С) азот взаимодействует с кислородом воздуха и образует оксид азота NO, который далее окисляется атмосферным кислородом до диоксида: 2NO+O2→2NO2. Затем оксиды, соединяясь с водой и солями в почве, переходят в нитриты и нитраты. Ежегодно молнии дают несколько миллионов тонн азотистых удобрений. Именно эти два источника — азотфиксирующие бактерии и молнии — позволяют растениям существовать и расти. Кроме того, опадающие листья и ветви образуют перегной, в котором сохраняется запасенный азот. Благодаря этому леса могут существовать неограниченно долго без дополнительных удобрений.
Ситуация меняется, когда с полей собирают урожай. По приблизительным подсчетам, ежегодно на земном шаре вместе с сельскохозяйственной продукцией вывозят около 100 млн тонн связанного азота. Столь громадный дефицит не могут восполнить природные процессы.
В растениях азот содержится в составе белков, далее он переходит в белки травоядных животных, затем — в белки хищников, питающихся травоядными. В состав молекул ДНК тоже входит азот. Поскольку белки и ДНК — основа всех живых организмов, можно утверждать, что от азота зависит жизнь на Земле. (Кстати, азот в переводе с греческого означает «безжизненный». Антуан Лавуазье предложил такое название для этого элемента, когда установил, что в состав атмосферы входит некое инертное вещество, не поддерживающее окислительные процессы.)
Фиксация атмосферного азота с помощью бактерий не менее важна, чем дыхание или фотосинтез (образование органических соединений из СО2 и Н2О). Благодаря ей громадные запасы атмосферного молекулярного азота превращаются в аминокислоты и белки. Недавние исследования показали, что азотфиксирующие бактерии могут жить не только на корнях растений, но и в кишечнике некоторых животных. Например, термиты питаются исключительно целлюлозой древесины, в которой азота нет. Долгое время было непонятно, из чего они делают белки. Оказалось, что в кишечнике термитов живут простейшие организмы — жгутиконосцы, в клетках которых находятся особые бактерии. Эти бактерии синтезируют специальный фермент, способный связывать атмосферный азот. Они снабжают им и простейшие организмы, и термитов — получается своего рода биохимическая матрешка.
Нехватка гуано как фактор кризиса
С калием и фосфором особых проблем нет — запасы минеральных соединений, содержащих эти элементы, велики. Из чего же можно сделать азотные удобрения? Стали искать природные запасы связанного азота и нашли. В первую очередь это нитрат калия KNO3, который содержится в минерале, названном «индийской селитрой». Ее в больших количествах стали вывозить из Индии и довольно быстро все запасы исчерпали. Надо отметить, что основное количество этого сырья использовали не как удобрение, а для производства пороха. Позже нашли другой источник селитры — гуано, разложившиеся естественным образом остатки помета птиц, представляющие собой смесь кальциевых, натриевых и аммонийных солей фосфорной, азотной и некоторых органических кислот. Громадные запасы гуано были обнаружены на тихоокеанском побережье Южной Америки. Миллионные колонии птиц, питающихся рыбой, — чайки, бакланы, крачки, альбатросы гнездились на скалистых берегах вдоль побережья Перу, Чили и на прибрежных островах. Поскольку в этом районе почти не бывает дождей, гуано накапливалось на побережье в течение многих веков, образовав в некоторых местах залежи толщиной в десятки метров и протяженностью свыше 100 км.
Спрос на гуано постоянно возрастал, потребность в нем достигла такого размаха, что в начале ХХ века его экспорт составлял миллионы тонн — запасы начали истощаться. Стали появляться мрачные прогнозы: английский зоолог Томас Гексли предрекал человечеству «азотный голод», английский физик Уильям Крукс также считал, что наступит продовольственный крах из-за полного исчерпания залежей чилийской селитры (напоминает нынешние беспокойства об истощении запасов углеводородного топлива).
Итак, необходимо было найти способ связывать атмосферный азот. Естественно, человечество в поисках промышленных способов производства азотсодержащих соединений не могло рассчитывать на бактерии и молнии. Впрочем, норвежские химики Кристиан Биркеланд и Сам Эйде сумели воспроизвести природный процесс, связав азот с помощью электрического разряда. Для этого они продували влажный воздух через электрическую дугу. Такой возможностью в начале ХХ столетия обладала, пожалуй, только Норвегия: множество гидроэлектростанций обеспечивало ее сравнительно дешевым электричеством. Образующуюся азотную кислоту переводили в нитрат кальция Ca(NO3)2, получивший название «норвежской селитры», и применяли как удобрение. Процесс был исключительно энергоемким, низкий выход азотной кислоты не мог покрыть возрастающую во всем мире потребность в азотных удобрениях. Однако химики нашли иной путь.
Крупная победа химии
В 1910 году произошло эпохальное событие: Фриц Габер и Карл Бош придумали, как превратить атмосферный азот в аммиак.
![]()
Катализирует процесс металлическое железо с примесями оксидов алюминия и калия, при температуре 400— 600°С и давлении до 1000 атмосфер. Найти катализатор оказалось непросто — Габер испробовал несколько тысяч различных соединений! За создание этого процесса Фриц Габер получил в 1918 году Нобелевскую премию (Карл Бош стал нобелевским лауреатом лишь в 1931 году, за развитие методов высокого давления в химии). Скромная экспериментальная установка Габера со временем превратилась в крупные заводы по производству аммиака (рис. 1).
 |
| 1. Экспериментальная установка Габера и современный завод по производству аммиака |
Условия, в которых происходит синтез аммиака (высокие температура и давление), весьма жесткие. Все из-за того, что N2 химически инертен. Два атома азота связаны тройной связью, но труднее всего разорвать в азоте первую связь из трех (для этого требуется 523 кДж/моль). Вторая связь раскрывается заметно легче (263 кДж/моль), еще легче третья (155 кДж/моль). Поэтому в реакциях с участием молекулярного азота обычно разрываются все три связи: если расшевелить самую прочную, то остальные сами «покатятся под горку».
Интересно, что совсем иначе обстоит дело с тройной связью между атомами углерода (например, в ацетилене): первую связь из трех разорвать нетрудно (нужно всего 222 кДж/моль), зато прочность второй связи заметно выше, а третьей еще выше. Поэтому из ацетилена и его производных можно получить соединение с двойной или одинарной связью, а полного разъединения атомов углерода обычно не происходит.
Итак, с помощью процесса Габера — Боша удалось химически связать атмосферный азот с водородом. Конечно, водород земная атмосфера не может нам предоставить, зато существует промышленный процесс его получения из метана и воды (также каталитический):
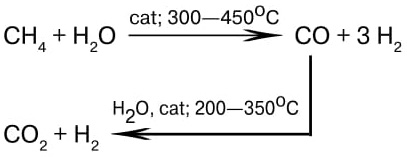
Сегодня громадное количество заводов синтезирует аммиак по способу Габера — Боша. Потом аммиак каталитически окисляют до оксидов азота, в итоге получают азотную кислоту и нитраты, которые, помимо сельского хозяйства и изготовления взрывчатых веществ, необходимы также в производстве красителей, медикаментов и во многих других областях химической индустрии.
Девяносто лет спустя
Синтез аммиака всесторонне изучали долгие годы, однако и через десятилетия оставалось неясным, как именно протекает процесс. За решение этой задачи взялся Герхард Эртль, сотрудник института, носящего имя Фрица Габера. Его успех также был вознагражден Нобелевской премией — в 2007 году.
 |
|
Герхард Эртль
|
В формулировке Нобелевского комитета сказано, что премия присуждена за изучение химических процессов на твердых поверхностях. Подавляющее большинство химических реакций протекает в газовой фазе или в растворе, тем не менее процессы, протекающие на твердых поверхностях, известны давно: прежде всего это гетерогенный катализ, когда реагенты — жидкости или газы, а катализатор находится в твердой фазе. Синтез аммиака — именно такой случай.
Чтобы объяснить, как работают гетерогенные катализаторы, предлагали различные теоретические схемы. Экспериментально изучать такие процессы до недавнего времени было очень трудно, для этого нужны особые условия — исключительно высокий вакуум, специально изолированные емкости и особо чистые реактивы, — а иначе не удавалось получить воспроизводимые результаты.
В 60-е годы ХХ века стремительно развивались новые технологии, в первую очередь производство микросхем. Чистота поверхности элементарного кремния, из которого делают процессоры, играет решающую роль, поэтому были созданы новые процессы получения сверхчистого кремния и разработаны чувствительные спектральные методы оценки чистоты.
Эртль сумел оценить новые методы и приспособить их для решения химических задач. Фактически он создал новую экспериментальную школу, которая позволила исследовать химию поверхности: облучать изучаемые объекты потоком электронов или фотонов и затем анализировать ответное излучение. При использовании фотоэмиссионного электронного микроскопа поверхность освещают ультрафиолетовым светом. При этом возникают фотоэлектроны, то есть электроны, возбужденные облучением. Те из них, которые обладают наибольшей энергией, отрываются от поверхности, преодолевая так называемую работу выхода. Эти электроны с помощью специальных линз направляют на люминесцентный экран. Картина, появляющаяся на экране, отражает состояние поверхности и положение находящихся на ней отдельных атомов. При обычном давлении пробег таких электронов очень короткий, поскольку они сталкиваются с молекулами газов в воздухе. Чтобы электроны, несущие важную информацию, дошли до экрана, необходим высокий вакуум, до 10-9 миллибар.
Заслуга Герхарда Эртля в том, что он научился наблюдать поведение отдельных атомов и молекул на исключительно чистых металлических поверхностях, комбинируя различные экспериментальные методики. Он зафиксировал явления, происходящие на поверхности катализатора, и объяснил, как все происходит на самом деле. В том числе и для химической фиксации азота в процессе Габера — Боша.
Танцы молекул на металлическом паркете
Вначале Эртль исследовал поведение молекул азота на поверхности чистого железа и обнаружил, что эти молекулы прилипают к поверхности, а затем крайне медленно распадаются на атомы (N2↔2N). Точно так же на поверхности железа распадаются и молекулы водорода, но это, как установил Эртль, проходит заметно легче.
Затем Эртль стал изучать реакцию на реальном катализаторе — железе, содержащем в качестве примеси оксид калия, и обнаружил, что в ней участвуют отдельные атомы N, а не молекула N2 (это было отдельное довольно сложное исследование). Он также установил, что присоединение атомов водорода проходит ступенчато, вначале один атом, затем два, потом три: N2↔:N↔:NH↔⋅NH2↔NH3 (рис. 2). При этом самая медленная стадия, определяющая общую скорость процесса, — первая (распад молекулы азота на атомы). Наименее прочно адсорбируется на поверхности катализатора молекула аммиака, что позволяет ей легко отделиться.
Эртлю удалось не только качественно описать всю схему, но и определить тепловые эффекты реакции на каждой стадии. Он также объяснил стимулирующую роль примесей оксида калия в металлическом железе — его добавка облегчает распад молекул азота на атомы, делая процесс энергетически более выгодным.
Напомним, что аммиак — не конечный продукт, его надо превратить в азотную кислоту и потом в нитраты. По той же схеме Эртль изучил целую серию процессов, прежде всего каталитическое окисление аммиака на платинородиевом катализаторе (процесс Оствальда), с помощью которого перерабатывают основную его массу. Он исследовал не только все основные стадии, приводящие к получению азотной кислоты, но и побочные.
Результаты, полученные Герхардом Эртлем, выходят далеко за рамки интересов химической индустрии. Найденные им закономерности можно использовать при описании процессов коррозии, в очистке сточных вод ив совершенствовании топливных элементов. И если Эртль начинал разрабатывать свои экспериментальные методы, взяв за основу технологии полупроводниковых производств, то созданные им установки для высокого вакуума, приемы для получения сверхчистых поверхностей, в свою очередь, оказались полезными для современной электроники и дали толчок к развитию новых полупроводниковых технологий.
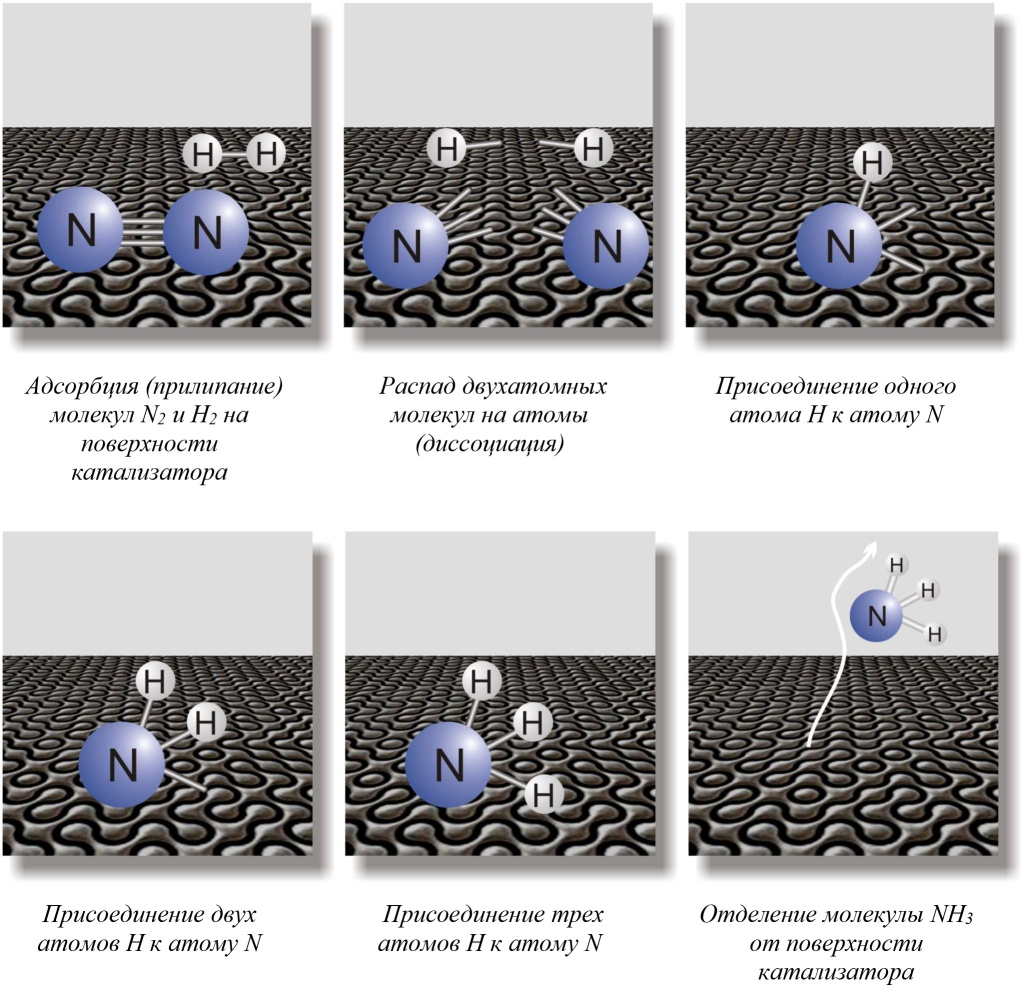 |
| 2. Синтез аммиака, описанный Эртлем |
Азотный фотосинтез?
Промышленное получение аммиака — процесс исключительно энергоемкий, проводят его в исключительно жестких условиях, поэтому химики давно пытаются найти способы фиксации азота, не требующие высоких температур и давлений, — делают же это одноклеточные существа. Манипуляции с бактериями и их ферментами оставим биотехнологам: химики обычно используют только подсказки, которые дает изучение природных процессов, а далее ищут свои пути, могущие оказаться более эффективными.
В те времена, когда Фриц Габер создавал свой процесс, представления о механизме катализа были развиты слабо, поэтому Габер искал катализатор перебором вариантов. Во второй половине ХХ столетия знаний стало больше, — например, теперь понятно, что при синтезе аммиака с участием катализатора — металлического железа молекулы азота вначале садятся на его поверхность, а затем металл оттягивает на себя электронные облака, соединяющие два атома азота, и связь между ними ослабляется. Дальше молекула уже может участвовать в различных превращениях. Известен также пример, когда молекула азота фиксируется на атоме переходного металла. При взаимодействии хлорида рутения с гидразином H2N—NH2 образуется комплекс, в котором гидразин превращается в аммиак и молекулярный азот, и оба образовавшихся соединения, в том числе нейтральная молекула азота N2, садятся на металл.
Получалось, что активировать молекулярный азот N2 можно будет в том случае, если азот, во-первых, образует комплекс с соединением переходного металла, а во-вторых — станет при этом достаточно активным.
В 1964 году российские ученые М.Е. Вольпин и В.Б. Шур (Институт элементоорганических соединений РАН) сообщили, что нашли способ восстанавливать молекулярный азот до аммиака в мягких условиях (рис. 3; см. также «Химию и жизнь» 2015 №12). Секрет метода — специально разработанные катализаторы, комплексы переходных металлов. Авторы установили, что катализировать такую реакцию могут многие вещества — соединения Ti, V, Cr, Mo, W. Однако «расшевелить» тройную связь между атомами азота недостаточно, нужно предложить ослабленной связи направление, в котором она должна реагировать. Кажется вполне естественным, что это должно быть восстановление, приводящее к образованию связи NH (самый простой вариант — аммиак). Поэтому в систему нужно добавить и восстановитель, например литийалюминийгидрид LiAlH4 (можно использовать и натрийборгидрид NaBH4 либо смесь Mg+MgI2). Вольпин и Шур пропускали азот через раствор, содержащий катализатор (соединение титана (C5H5)2TiCl2 и восстановитель C2H5MgBr), и получался аммиак NH3.
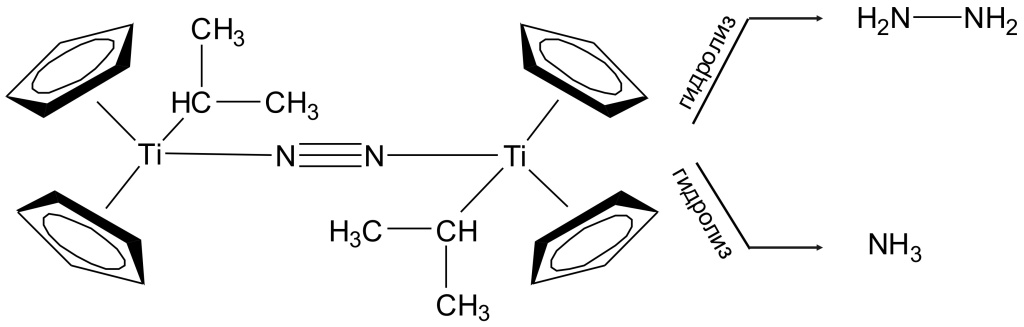 |
| 3. Схема реакции Вольпина — Шура |
Этот результат был абсолютно новым и крайне важным, поэтому авторы приложили особые усилия, чтобы доказать его истинность. Необходимо было исключить возможность, что источники аммиака — различные азотсодержащие примеси в используемых реактивах. Были проведены специальные опыты, в которых использовали исходный молекулярный азот N2, содержащий изотоп 15N.
Удалось детально описать процесс. В реакционной смеси образуется промежуточное соединение — комплекс титана, в нем атом металла окружен двумя циклическими молекулами С5Н5 и группой –СН(СН3)2. Азот встраивается между двумя такими молекулами (этот агрегат даже удалось зафиксировать при низкой температуре), а затем в результате гидролиза образует гидразин H2N-NH2 либо аммиак NH3.
Напомним, что катализатор должен работать в небольших количествах, обеспечивая превращение большого количества реагентов. Однако эта система позволяла получать аммиак при соотношении «одна молекула NH3 на один атом Ti». Практически это не катализ, а обычная реакция, поскольку соединение титана участвует в ней как рядовой реагент. Авторам работы удалось найти каталитическую систему ТiСl4—АlВг3—Al, которая при давлении 10 МПа и 130°С дает почти 300 молей аммиака на моль ТiСI4. Такое соотношение можно уже рассматривать как истинный катализ.
Затем авторы обнаружили, что, если в состав восстанавливающего компонента ввести фенильную группу, из молекулярного азота получается анилин. Такой результат впечатляет — фактически это получение промышленно важного органического вещества непосредственно из азота.
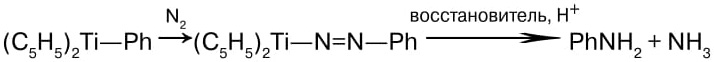
Интересно, что открытие фиксации азота было даже упомянуто в кинофильме. В 1981 году вышел фильм Леонида Марягина «Незваный друг». Там есть такой эпизод: молодой ученый (его играет Олег Даль) подает своему бывшему научному руководителю (Олег Табаков) готовую диссертацию, тема — фиксация азота. Бывший руководитель одобрительно замечает: «Да, парень, это ты замахнулся! Проблема-то больно крепенькая» (рис. 4).
 |
| 4. Кадр из фильма «Незваный друг» |
Открытие фиксации молекулярного азота в мягких условиях стало заметным этапом в науке о катализе и вызвало к жизни новое направление исследований. Например, академик РАН А.Е. Шилов с сотрудниками разработал каталитические системы, которые фиксируют атмосферный азот в водно-спиртовой среде (катализаторы — смесь гидроксидов магния, ванадия(II) и калия, а также комплексы молибдена с гидроксидом титана).
Поиски новых каталитических систем продолжаются, в 2015 году исследователь из Северо-Западного университета США Меркюри Канацидис с коллегами сообщил, что смешанный сульфид молибдена и железа Mo2Fe6S8 в присутствии сульфида олова Sn2S6 и органических лигандов образует гель, который способен превращать азот в аммиак при облучении светом («Journal of the American Chemical Society»). По аналогии с фотосинтезом зеленых растений, превращающих СО2 и Н2О в глюкозу, эту реакцию можно назвать фотосинтезом аммиака из азота.
Результаты, безусловно, необычные и перспективные, но пока что они, увы, далеки от промышленного внедрения. Некоторые катализаторы нестабильны, синтез многих из них сложен, что повышает стоимость получаемых продуктов, да и производительность все еще низка. Азот задал химикам непростую задачу. Но безусловно, в будущем ученые все-таки найдут новые способы связывать атмосферный азот в мягких условиях, которые удастся реализовать и в промышленности.
 |
| Марк Ефимович Вольпин (1923—1996) и Владимир Борисович Шур (1936) |
Кандидат химических наук
М.М. Левицкий
Дожигание
Герхард Эртль исследовал еще один интересный процесс, о котором стоит рассказать отдельно. Известно, что бензин сгорает в двигателях автомобилей не полностью, в выхлопных газах содержится не только диоксид углерода СО2 (экологически безвредный), но и исключительно ядовитый монооксид углерода СО. Для борьбы с этим явлением используют каталитический процесс окисления СО до СО2, называемый в быту дожиганием: 2СО+О2→2СО2.
Выхлопные газы проходят через специальную насадку, содержащую катализатор окисления — металлическую платину.
Простая на первый взгляд реакция протекает весьма необычно. Оказалось, что она имеет колебательный характер, то есть пульсирует. Проведя исследование с использованием современных спектральных методов, Эртль установил, что, когда на отдельных участках каталитической поверхности концентрация СО превышает определенную величину (приблизительно 0,5 моль/л), поверхность перестраивается.
Изменения поверхности обратимы, и при снижении концентрации СО до 0,2 моль/л она приходит в прежнее состояние. Перестройка поверхности несколько отстает по времени от изменения концентрации СО. В итоге можно видеть, как по поверхности катализатора расходятся концентрические волны.
Картина не только красивая, но и весьма необычная: она показывает перестройку поверхности твердого тела под действием газообразного реагента. Фактически Эртль обнаружил неизвестное до него явление.
 |
| Колебательная реакция на поверхности катализатора в дожигателе |
См. также:
Азот: факты и фактики
