Синтетическая биология: конструирование живого
Мы научились создавать генно-модифицированные организмы, организмы с отредактированным геномом. Но модификации и редактирование — еще не конструирование с нуля, из стандартизированных элементов по известным правилам. Инженерия живых систем — следующая цель современных биологических наук.
 |
|
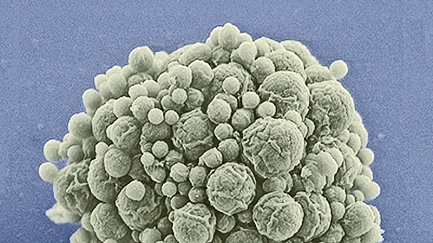
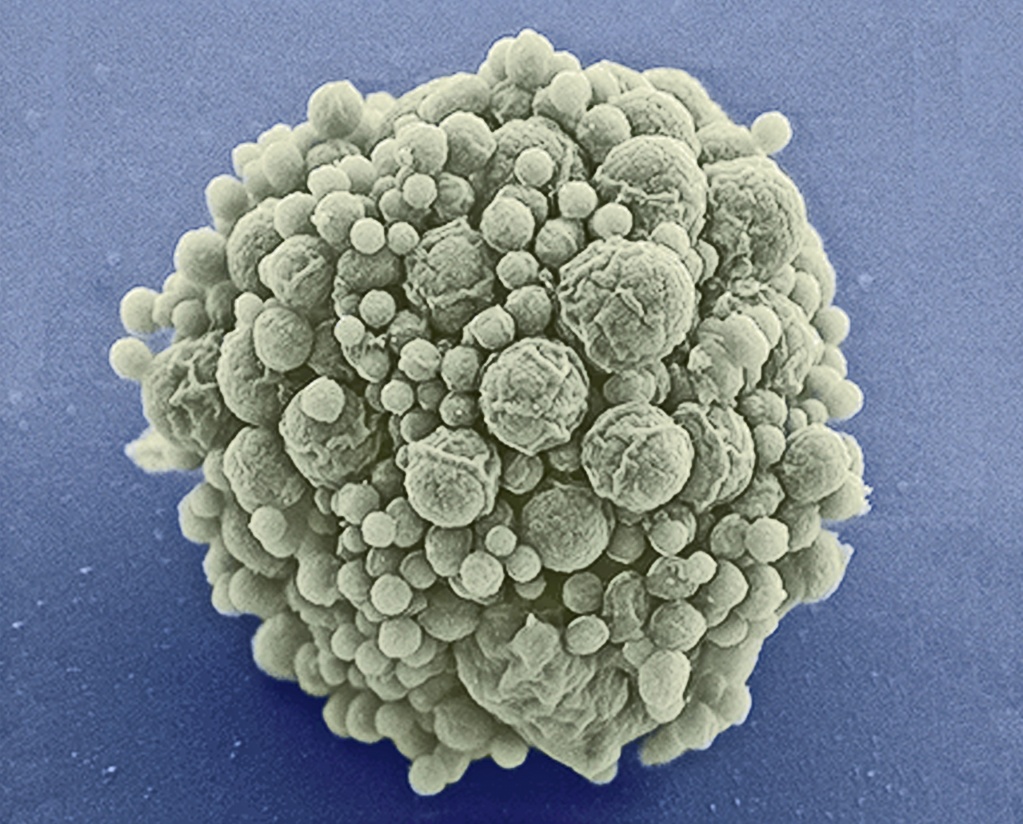
Синтетическая бактерия — Mycoplasma laboratorium JCVI-syn3.0 |
Еще одна инженерная дисциплина
Ход научно-технического развития человечества можно описать простой формулой «от познания — к созданию». Открытия фундаментальной науки пробуждают интерес к разработке на их основе новых устройств, машин, технологий. Так, открытый Гансом Эрстедом алюминий преобразовал металлургию и промышленность, благодаря катализаторам Карла Циглера и Джулио Натты стало возможным современное производство пластмасс. Открытие радиоволн привело к созданию радиосвязи, открытие свойств полупроводников — к созданию современных компьютеров. При этом в областях знаний, которые принято называть техническими, прогресс обычно связан с постепенным усложнением. Каждый год появляются более сложные электронные устройства, более функциональные машины и роботы, возрастает сложность самих материалов и новых химических веществ.
Вид деятельности, связанный с рациональным проектированием и построением технических систем из более простых элементов, принято называть инженерией. Это верно для многих отраслей инженерии: физико-технической, электротехнической, компьютерной и программной, химической.
Однако биология развивалась в несколько иных условиях. Живые организмы, созданные природой, сами по себе настолько сложны, что ученые долгое время были заняты в основном сбором эмпирических фактов, пытались понять и описать принципы функционирования живых систем. К концу 1940-х годов, когда уже была открыта квантовомеханическая картина строения атома и молекул, созданы первые ЭВМ, во многих странах появились телевизионные станции, — базовые механизмы работы живых систем были еще непонятны. Основоположник квантовой механики Эрвин Шредингер в книге «Что такое жизнь с точки зрения физики?», вышедшей в 1944 году, рассуждал о генах как о некоторых абстрактных апериодических кристаллах.
Лишь в 1953 году, когда Джеймс Уотсон и Френсис Крик расшифровали структуру двойной спирали, завеса над принципами функционирования живых организмов начала приоткрываться. К началу 1970-х годов исследователи научились использовать специальные ферменты — рестриктазы, разрезающие молекулы ДНК, и лигазы, сшивающие их. Это открыло путь к манипуляциям с ДНК и в конечном счете к созданию генно-модифицированных организмов. В 1973 году Герберт Бойер, Стэнли Коэн и Пол Берг создали первую бактерию с геном устойчивости к антибиотику, заимствованным у другой бактерии, и это событие стало началом генной инженерии.
Но из-за сложности устройства биосистем подходы, используемые в новой инженерной дисциплине, разительно отличались от тех, которые сложились в технических науках. С одной стороны, эти подходы во многом основывались на методе проб и ошибок, а с другой стороны, ограничивались набором базовых манипуляций с имеющимися в природе генетическими элементами. Иными словами, и «рациональное проектирование», и «создание сложного из простого» пока доступно в биологии лишь с серьезными оговорками. Тем не менее наши представления об устройстве живых организмов становятся все более точными, благодаря автоматизации и роботизации мы можем проводить более сложные эксперименты, а компьютерные технологии помогают анализировать, моделировать и структурировать биологические системы.
Стремление создавать новые живые системы с полезными свойствами подобно тому, как создаются машины, самолеты, компьютеры, стало основой научного направления, которое получило название синтетической биологии.
Цифровой код ДНК
Запись информации в цифровом виде, в форме последовательности единиц и нулей совершила революцию в технике. Цифровой код дает возможность многократно копировать и передавать информацию без потери качества, использовать одни и те же механизмы записи и обработки для информации любого рода (текст, видео, аудио и т. д.), а компьютерные программы, записанные в цифровом виде, позволяют компьютерам и роботам выполнять одни и те же операции неограниченное число раз с высокой точностью.
Однако природа изобрела цифровое кодирование уже около 4 миллиардов лет назад. Первые протоорганизмы, давшие начало всему разнообразию живого на планете, содержали молекулы нуклеиновых кислот, в которых дискретным образом (то есть в виде четко отграниченных элементов) были закодированы инструкции о строении и функционировании этих организмов. Сейчас считается, что изначально носителем генетической информации была РНК, в ходе эволюции эта функция перешла к родственным, но более стабильным молекулам ДНК, а молекулы РНК стали выполнять вспомогательные функции.
ДНК представляет собой полимер из звеньев четырех типов — дезоксирибонуклеотидов аденина, тимина, гуанина и цитозина (А, Т, Г, Ц). Совокупность молекул ДНК в живой клетке называется геномом организма. Двухцепочечная спиральная структура молекул ДНК позволяет хранить и копировать информацию. По своей сути последовательности нуклеотидов в молекулах ДНК и РНК — это четырехбуквенный дискретный цифровой код. Исполняя последовательность операций, записанных в генетическом материале, живые организмы растут, живут — и размножаются, передавая информацию потомкам.
Чтобы понять смысл информации, закодированной в ДНК, нужно научиться ее читать. Первые технологии секвенирования — чтения последовательности мономеров в биополимере (скажем, в молекуле ДНК или РНК) — появились в 70-е годы XX века. Метод секвенирования ДНК, разработанный Фредериком Сенгером (см. «Химию и жизнь» 2018 №8), позволяет прочитывать до тысячи нуклеотидов за раз; более 30 лет он оставался основным методом секвенирования ДНК и не потерял своей значимости до сих пор. Один из самых масштабных международных проектов в истории биологии — «Геном человека» — использовал именно секвенирование по Сенгеру.
Проект начался в 1990 году под руководством Джеймса Уотсона. Планировалось, что он займет 15 лет, а общие затраты составят 3 миллиарда долларов. Перед исследователями стояла задача прочитать 3,3 миллиарда нуклеотидов человеческого генома. Для этого геном разрезали на фрагменты длиной около 150 тысяч нуклеотидов, которые можно было копировать в бактериях. Затем устанавливали положение этих фрагментов в хромосомах, создавая так называемую физическую карту генома. На втором этапе фрагменты разбивали на множество перекрывающихся случайных подфрагментов, которые секвенировали методом Сенгера, а затем состыковывали полученные последовательности с помощью специального программного обеспечения.
Однако в 1998 году аналогичный проект с частным финансированием начал Крейг Вентер, рассчитывая опередить государственный проект. Вентер отказался от разбиения генома на большие фрагменты и их картирования в его проекте секвенировались миллионы перекрывающихся коротких фрагментов генома, а сборка исходной последовательности происходила за счет инновационных вычислительных алгоритмов. Конкуренция ускорила достижение цели: уже в 2000 году был представлен черновой вариант генома, а в 2003-м анонсировано официальное завершение проекта. Общие расходы составили около 5 миллиардов долларов в ценах 2019 года, или около 1,5 доллара за каждый секвенированный нуклеотид.
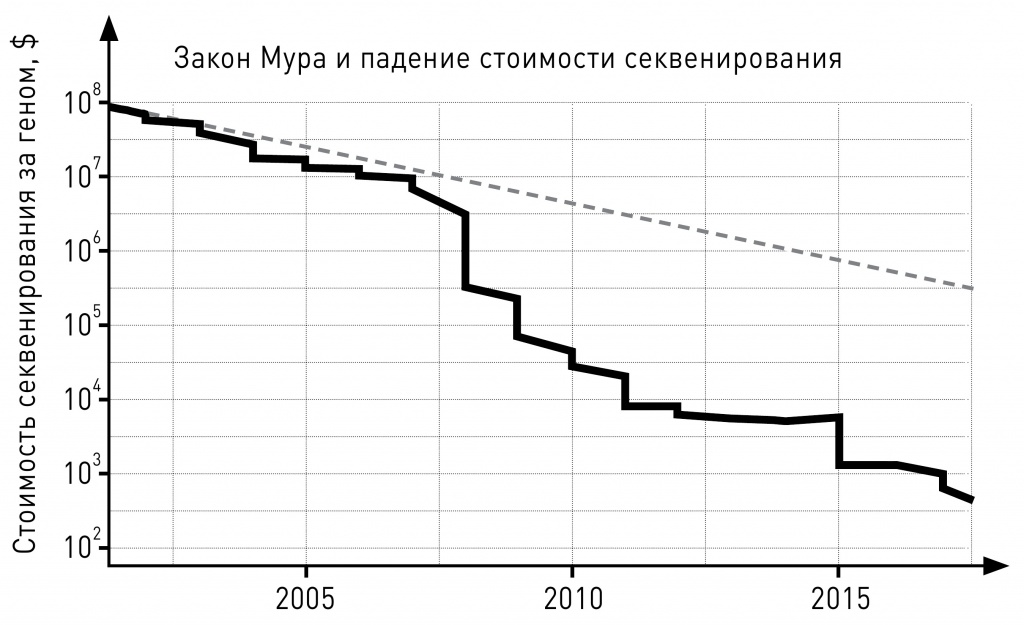
В XXI веке начали стремительно развиваться технологии секвенирования нового поколения. Современные приборы-секвенаторы читают сотни миллионов коротких последовательностей одновременно, а компьютерные и программные технологии эффективно обрабатывают эти данные. Стоимость секвенирования генома одного человека по состоянию на 2019 год составляет менее тысячи долларов. Это фантастическое падение цен (более чем в миллион раз!) способствовало бурному прогрессу многих областей биологии.
 |
|
Динамика цен на полногеномное секвенирование. Пунктиром показано экспоненциальное снижение (примерно так бы дешевело секвенирование, если бы следовало закону Мура) |
Заметим, что с экономической точки зрения зачастую важно не столько абсолютное удешевление, сколько более-менее постоянная тенденция к удешевлению. В компьютерной индустрии хорошо известен так называемый закон Мура, гласящий, что количество транзисторов на микросхемах удваивается каждые полтора-два года. Данная тенденция уже более 50 лет остается драйвером развития всей компьютерной отрасли. Возможности по секвенированию ДНК в последние 20 лет росли еще быстрее. Это, с одной стороны, привело к взрывному росту биоинформатики, геномики, персонализированной медицины, а с другой — методы анализа данных стали играть более важную роль, чем их получение.
Чтение, правка и запись
Кроме секвенирования нового поколения появились и другие технологии, изменившие правила игры. Мы уже упоминали о технологиях, позаимствованных у природы, которые легли в основу новой отрасли — генной инженерии: о ферментах рестриктазах и лигазах, разрезающих и сшивающих ДНК. Однако за 40 с лишним лет генная инженерия значительно увеличила свой арсенал инструментов. В частности, гены теперь можно редактировать не в пробирке, а прямо внутри живых систем.
Общий принцип работы инструментов для такого редактирования — узнавание целевой последовательности ДНК и внесение разрыва в выбранном месте с помощью фермента нуклеазы. Следующий этап — починка (репарация) поврежденной ДНК, его выполняет сама живая клетка. При этом и возникает запланированное изменение последовательности в ДНК — удаление части ДНК или, скажем, замена мутации на нормальную последовательность гена (для замены системе репарации нужен участок ДНК без мутации, внесенный извне или уже находящийся в клетке, например копия того же гена в другой хромосоме, см. «Химию и жизнь» 2017 №9).
Одним из первых популярных редактирующих инструментов стала система TALEN — белок-химера, состоящий из нуклеазы и пришитого к ней ДНК-связывающего домена, который распознает участок генома, выбранный для редактирования. ДНК-связывающий домен собирают, как конструктор из деталей, заново для каждой целевой последовательности; кроме того, систему TALEN трудно доставить в клетки. Но затем появилась альтернатива, система CRISPR-Cas9. Белок Cas9 — тоже нуклеаза, но распознавание нужного участка обеспечивает не белок, а направляющая РНК, комплементарная этому участку. Синтез РНК куда менее трудоемкая задача, чем конструирование ДНК-связывающего белка, поэтому система CRISPR-Cas9 стала одной из самых перспективных технологий редактирования генома, дав начало волне новых исследований, от метаболической инженерии микроорганизмов (перестройки обмена веществ в бактериальной клетке) до лечения наследственных заболеваний человека.
Параллельно развивались и методы химического синтеза ДНК, его стоимость тоже снижалась, автоматизация же позволила строить длинные цепи ДНК. В 2008 году синтезировали молекулу ДНК длиной в 582 970 пар нуклеотидов, о чем существует запись в книге рекордов Гиннесса. Молекула была геномом бактерии Mycoplasma genitalium, а работа проводилась под руководством Крейга Вентера. В 2010 году та же группа ученых опубликовала результаты еще более интересного эксперимента. Синтезированный с нуля геном другого вида микоплазмы — M. mycoides длиной около 1,1 миллиона пар нуклеотидов пересадили в бактерию третьего вида, M. capricolum, из которой предварительно изъяли ее собственный генетический материал. Полученный организм — первое в мире живое существо с синтетическим геномом — продемонстрировал характеристики вида M. mycoides. Очевидно, именно после этого в научном сообществе и медийном пространстве стал активно использоваться термин «синтетическая биология».
Следующая цель Крейга Вентера и его коллег еще более амбициозна: создание организма с набором генов, не встречающихся в природе. Пока что они сконструировали клетку с минимальным геномом, удалив несущественные для выживания участки из генома M. mycoides. Результат нескольких лет экспериментов — M. mycoides JCV-syn3.0 — был представлен научной общественности в 2016 году. У этой вполне жизнеспособной бактерии осталось всего 473 гена, тогда как 428 генов исследователи смогли удалить (см. «Химию и жизнь 2016 №5). Можно представить, что на основе подобных организмов специалисты когда-нибудь будут конструировать бактерий с нужными свойствами, добавляя дополнительные гены к «минимальной конфигурации».
От синтетической биологии к генной инженерии и обратно
Французский биолог Стефан Ледук еще в 1912 году написал книгу под названием «Синтетическая биология», но речь в ней шла о некотором философском синтетическом подходе к познанию живых систем, о воссоздании их поведения на основе известных «физических сил». Потребовалось более 50 лет, чтобы «физические силы», лежащие в основе поведения биосистем, стали известны. Однако и тогда говорить о создании биосистем на их основе было рано. Заимствованные у природы ферменты резали, сшивали и копировали ДНК, формируя нужные исследователю конструкции, но и сами фрагменты ДНК, кодирующие различные функциональные элементы, были созданы природой, а не человеком. Экспериментатор мог выполнять ограниченные по сложности манипуляции с генетическим программами: удалять один или несколько генов, переносить отдельные гены из одного организма в другой. По сути, это был подход по принципу «сверху вниз» (top-down).
В то же время подходы, используемые инженерами в электронике, вычислительной технике, машиностроении и т. д., основаны на создании сложных систем с нуля — соединении, комбинировании более простых элементов, которые, в свою очередь, состоят из комбинаций еще более простых элементов. Однако в генной инженерии такой подход — «снизу вверх»; (down-top) — практически не использовался. Данное противоречие и вызвало к жизни термин «синтетическая биология» в его нынешнем понимании для обозначения «настоящих» инженерных подходов к решению задач, которые традиционно относились к области генной инженерии.
Становлению синтетической биологии способствовал интерес ученых из областей компьютерной и электротехнической инженерии к решению биологических задач. Одним из основоположников направления стал американский компьютерный инженер Том Найт. Его иногда называют крестным отцом синтетической биологии, но в компьютерной среде он известен разработкой первых компьютеров для языка программирования Lisp и работой над сетью ARPANET, на основе которой затем возник Интернет. В 1990-х годах Том Найт заинтересовался работой с биологическими системами и применением к их дизайну инженерных принципов. В результате в начале 2000-х был создан стандарт хранения и работы с фрагментами ДНК BioBricks (подробнее о нем расскажем позже), который позволил упростить и стандартизировать хранение и сшивку фрагментов ДНК.
Сразу отметим, что «синтетическая биология» — это не только генная инженерия: широкая трактовка термина предполагает применение инженерных принципов к разнообразным задачам. Речь может идти об инженерии не только на уровне отдельных клеток, но и тканей, органов, организмов, а также о создании интерфейсов между живыми организмами и электронными устройствами.
Обычно выделяют несколько главных принципов инженерии — автоматизацию, абстракцию, стандартизацию и разделение труда. Как это будет выглядеть применительно к биосистемам?
Принципы инженерии в биологии
Автоматизация в синтетической биологии — это прежде всего роботизированные системы для проведения экспериментов и компьютерные программы, упрощающие проектирование биосистем, так называемые биологические САПР (системы автоматизированного проектирования).
Роботизация экспериментальных процедур позволяет проводить сложные эксперименты быстрее и точнее, чем это сделал бы человек. Она способна решить и весьма актуальную проблему воспроизводимости результатов экспериментов в разных лабораториях. Когда протокол эксперимента записан в виде программы, выполняемой роботом, с одной стороны, устраняется так называемый человеческий фактор, а с другой стороны, протокол прописан намного более детально, чем это можно сделать в научной статье.
Дальнейшее развитие идеи роботизации биологических экспериментов — создание «облачных лабораторий». Например, компания Emerald Cloud Lab уже сейчас предлагает полностью автоматизировать работу «мокрых» биологов (тех, кто работает в лаборатории с реальными биомолекулами и биообъектами, в отличие от все более многочисленных биологов, чье рабочее место — исключительно за компьютером). Выбирая готовый протокол из предложенных на сайте, ученые задают последовательность операций, которую нужно выполнить с образцами. После этого полностью роботизированная система, находящаяся в удаленной «облачной» лаборатории, исполняет все команды, и ученым остается только проанализировать результаты. По аналогии с облачными вычислительными сервисами такой подход серьезно уменьшит издержки пользователей — оборудование будет меньше простаивать и совместно использоваться многими клиентами сервиса.
Без систем автоматизированного проектирования сегодня немыслима разработка любых устройств — от мебели до самолета. САПР пришли и в биологию. Некоторые программы (например, j5) автоматически разрабатывают протокол эксперимента по соединению фрагментов последовательностей ДНК в более сложную конструкцию. Другой класс программ, таких как Cello, предназначен для автоматизированного создания генетических сетей (о них речь пойдет ниже).
Понятие абстракции получило особенно широкое распространение в программировании и компьютерных науках. Суть этого подхода в том, что при описании реальных объектов строится упрощенная модель, которая принимает во внимание только параметры, важные для взаимодействия объекта с другими объектами системы, а детали опускаются. Применяя такой подход на разных уровнях организации системы, можно создать ее иерархическую абстрактную модель, где на каждом уровне будут выделены важные параметры подсистем, а детали спрятаны на более нижних уровнях иерархии. Абстракция дает множество преимуществ. Во-первых, работа системы или любой подсистемы представлена в достаточно простом виде, во-вторых, при наличии элементной базы нет необходимости проектировать систему с самых нижних уровней иерархии, в-третьих, инженеры, работающие на определенном уровне, не обязаны обладать квалификацией для работы на других уровнях. Так, инженер по проектированию персональных компьютеров не должен разбираться в устройстве транзисторов. Применение подобного подхода при проектировании биосистем — одна из важных целей синтетической биологии.
Стандартизация — ключевое условие для развития любой области инженерии, она удешевляет и ускоряет создание новых систем, а также позволяет участвовать в их создании все большему числу заинтересованных людей. Введение стандартов при разработке элементной базы компьютерных систем обеспечило взрывной рост компьютерных технологий; в самом начале бума персональных компьютеров умельцы собирали первые ЭВМ в прямом смысле слова в гараже, поскольку существовали стандарты. Синтетическая биология тоже ставит перед собой задачу разработать четкие правила, принять единые стандарты и протоколы, создать единые банки-репозитории биологических элементов и тем самым упростить конструирование биосистем.
Под «биологическими элементами» чаще всего понимают генетические элементы, то есть фрагменты ДНК. Важной вехой в области стандартизации работы с генетическими элементами стало создание стандарта BioBricks, который дает возможность собирать масштабные генетические конструкции из отдельных элементов — «биокирпичей». Последовательность ДНК каждого «биокирпичика» состоит из смысловой части, к которой по бокам пришиты специальные последовательности — префикс и суффикс, и всё вместе помещено в небольшую кольцевую молекулу ДНК, которая также содержит инструкции для ее копирования бактериями (бактериальная клетка здесь выступает в роли «кирпичного завода»). В префиксе и суффиксе есть участки узнавания ферментами-рестриктазами, подобранные так, чтобы «кирпичики» было удобно монтировать. На основе такого стандарта создан биобанк — реестр стандартных биологических деталей (Registry of Standard Biological Parts). В его библиотеке зарегистрировано уже более 20 тысяч элементов, и каждый год ее пополняют участники знаменитого конкурса по синтетической биологии iGEM (The International Genetically Engineered Machine Competition — буквально «международное состязание генно-инженерных машин»).
Перечисленные принципы инженерии создают предпосылки для разделения труда между разными группами, работающими над проектированием целой системы. Однако еще одной важной особенностью, свидетельствующей о высоком уровне развития технологии, считается разделение труда между проектированием (дизайном) и производством. Сегодня сложно представить архитектора, который сам участвует в постройке здания, а в биологии зачастую одни и те же специалисты продумывают дизайн генетической конструкции и собирают биосистемы. Ожидается, что с развитием синтетической биологии эти функции будут все сильнее разделяться. Однако из-за сложности и непредсказуемости биосистем к их проектированию, скорее всего, начнут применять итеративный подход «дизайн — построение — тестирование — дизайн» (design-build-test).
От электрических схем к генным сетям
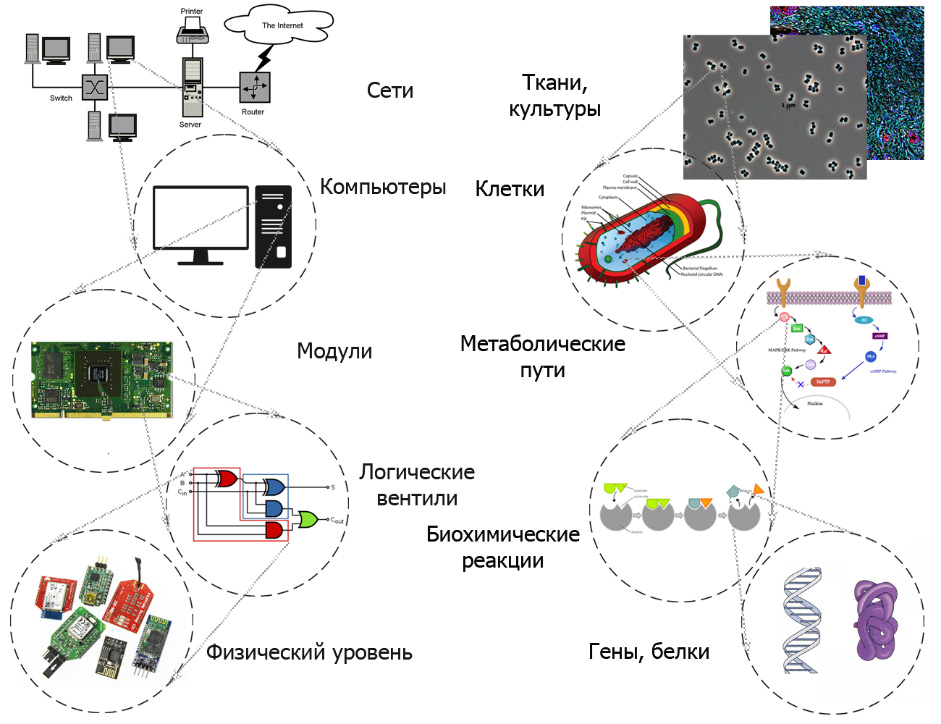
Поиск аналогий между электронными приборами и биологическими системами сильно повлиял на подходы и терминологию синтетической биологии. Аналогом понятия интегральной микросхемы (integrated circuit), главным образом как некоторого устройства, обрабатывающего электрические сигналы, стало понятие генетической схемы genetic circuit (также в русскоязычной литературе принят термин «регуляторный контур»). Так называют генетическую программу, которая инструктирует клетку однозначным образом обрабатывать сигналы, такие как появление определенных молекул.
Для того чтобы биоинженеры могли создавать сложные системы, с высокой точностью исполняющие свои функции, нужны генетические программы, которые играли бы роль логических элементов, подобно транзисторам в электротехнике. Такие логические элементы можно создать, например, на основе известных систем регуляции экспрессии генов.
Вспомним знаменитую регуляторную систему кишечной палочки, описанную в 1961 году Франсуа Жакобом и Жаком Моно, — лактозный оперон, то есть совокупность совместно регулируемых генов, которые кодируют ферменты, обеспечивающие метаболизм углевода лактозы. Если в среде имеется глюкоза, бактерия предпочитает ее, а усвоением лактозы себя не затрудняет. Лактозный оперон включается только в том случае, когда в среде есть лактоза и нет глюкозы. Как это происходит? Молекула лактозы присоединяется к белку-репрессору, который связывается с участком ДНК перед кодирующими последовательностями генов и блокирует возможность их считывания; после этого репрессор отсоединяется от ДНК, а при снижении концентрации глюкозы приходит сигнал активации оперона. Короче говоря, лактозный оперон ведет себя как логический элемент: в зависимости от информации на входе принимает значения 0 (ферменты не синтезируются) либо 1 (ферменты синтезируются).
В конце 1990-х Джеймс Коллинз, Чарльз Кантор и Тим Гарднер стали создателями первого искусственного генетического триггера. (В электротехнике триггер — устройство, способное подолгу находиться в одном из двух устойчивых состояний и чередовать их под воздействием внешних сигналов, то есть ведет себя как лактозный оперон.) триггер Коллинза и Гарднера представлял собой систему из двух генов, A и B, подавляющих активность друг друга. Чуть позже Майкл Эловиц и Станислав Лейберг сконструировали первый биологический осциллятор, названный репрессилятором, — систему из трех генов, соединенных между собой механизмами обратной связи. Продукт первого гена подавляет действие второго, второй — третьего, третий — первого. Концентрации трех белков представляли собой гармонические колебания с заданными значениями амплитуды.
Идея создания биологических аналогов осциллятора и триггера пришла из электрической инженерии, однако за основу были взяты системы, существующие в природе. Основой для осциллятора стала генетическая конструкция, отвечающая за суточные ритмы у цианобактерий, а для триггера — генетическая система бактериофага лямбда, ответственная за вступление бактериофага в литический цикл (переход к размножению и уничтожению бактерии-хозяина).
 |
|
Компьютеры и биосистемы: аналогия иерархических уровней |
Сегодня прогресс в синтетической биологии достиг такого уровня, что особо амбициозные исследователи вроде Крейга Вентера и его команды замахнулись на создание живых организмов de novo с полностью синтетическим геномом. Близится переход от копирования живой природы к сборке организма, в природе не существующего, из элементов «генетического конструктора». Однако создание сложных систем, принимающих на вход много сигналов, сопряжено с принципиальными проблемами. Например, из-за высокого уровня шума и сложности связей, объединяющих клеточные компоненты, предсказать поведение системы, состоящей из большого числа элементов, практически невозможно.
Одно из перспективных направлений, которые позволят решить эту проблему, — системы на основе РНК-РНК взаимодействий. О регуляции с помощью РНК в живой природе, ее эффективности и гибкости мы в последние годы узнаем все больше. Использование малых РНК для передачи сигнала позволяет нивелировать задержки, типичные для систем, основанных на взаимодействии ДНК — белок, и повышает точность клеточных «вычислений». Другое немаловажное преимущество — возможность применения одних и тех же регуляторных элементов как в прокариотических, так и в эукариотических клетках. Самая большая на сегодняшний день генетическая конструкция, способная функционировать in vivo, создана из нескольких взаимосвязанных РНК-переключателей и принимает на вход 12 сигналов. Она была описана в 2018 году в журнале Biochemistry исследователями из Гарварда и Университета штата Аризона.
Успехи и перспективы
Создание искусственного организма с искусственными генами — дело неблизкого будущего. Но уже сегодня подходы синтетической биологии хорошо показали себя в различных областях, от создания биокомпьютеров до управления дифференцировкой стволовых клеток.
Искусственный морфогенез. Потенциал применения человеческих индуцированных плюрипотентных стволовых клеток велик. Сегодня их главным образом используют в исследовательских целях, например для скрининга лекарственных препаратов. Однако их планируют применять также в клеточной терапии и создании искусственных органов. Перепрограммирование этих стволовых клеток в определенную клеточную линию — дорогостоящий и длительный процесс. Большинство протоколов предполагает обработку клеточных культур коктейлем из транскрипционных факторов, набор и время воздействия которых определяется экспериментально, и даже в случае успеха эффективность подобной процедуры невелика. Но есть альтернативный вариант — внедрить генетическую информацию о синтезе факторов транскрипции в стволовые клетки и тем самым перепрограммировать их. Например, с помощью РНК-сети, внедренной в стволовые клетки, были созданы инсулинсекретирующие клетки, подобные бета-клеткам поджелудочной железы (публикация 2016 года), — это путь к лечению диабета, альтернатива лекарствам и трансплантации поджелудочной железы.
Биосенсоры — устройства, которые быстро и с высокой точностью выявляют широкий спектр молекул, — используются при контроле производства пищевых продуктов, качества воды и проверки почвы на загрязнение и зачастую способны заменить целую лабораторию в полевых условиях. В прошлом году много писали о методе с забавным названием SHERLOCK и о других тестах на основе CRISPR. Как и редактирующие CRISPR-системы, они находят определенную последовательность в ДНК и затем генерируют сигнал, например, вызывают флуоресценцию, которую легко зарегистрировать (см. «Химию и жизнь» 2018 №7). Подобные тест-системы обнаруживают ничтожно малые концентрации патогена, выявляют различия в геномах пациентов или возбудителей заболевания.
Синтез лекарств. Малярия до сих пор остается одним из опаснейших заболеваний и ежегодно уносит десятки тысяч жизней. Китайский фармаколог Юю Ту в поисках противомалярийного препарата обратилась к средствам народной медицины. Ее поиски увенчались успехом и принесли ей Нобелевскую премию: был открыт артемизинин, выделенный из полыни однолетней (см. «Химию и жизнь» 2015 №11). Но возникла новая проблема: получение жизненно необходимого препарата зависело от того, вырастет полынь или нет. Альтернативу предложил Джей Кислинг, профессор химической инженерии и биоинженерии Калифорнийского университета в Беркли. Его команде удалось с нуля создать метаболический путь синтеза предшественника артемизинина в клетках дрожжей. Теперь у человечества есть дополнительный источник этого препарата, который может стать основным в случае необходимости.
 |
|
Исследователи, внесшие наибольший вклад в разработку противомалярийного препарата — артемизинина: Юю Ту и Джей Кислинг |
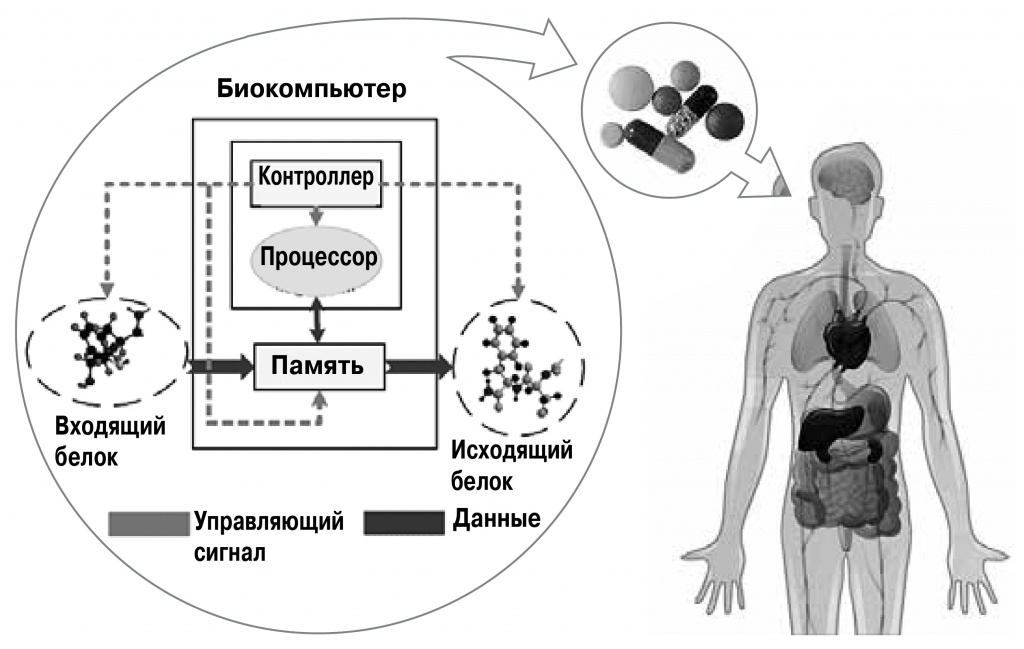 |
|
Так могли бы работать медицинские биокомпьютеры в человеческом организме: модуль памяти хранит информацию о перенесенных заболеваниях, вычислительный модуль по концентрациям определенных молекул (например, антигенов) оценивает состояние пациента и в случае необходимости сигнализирует о необходимости лечения |
Биотопливо. Биомасса — потенциальный источник возобновляемого топлива. Чтобы повысить содержание высокоэнергетических веществ в биомассе, микроорганизмы помещают в экстремальные условия: масла они вырабатывают в качестве защиты. Синтетическая биология предлагает другой способ — перепрограммировать метаболические пути и создать модифицированные штаммы, которые быстрее делятся и накапливают значительно больше богатых энергией соединений. Модифицировать можно кишечную палочку, хорошо изученную и прекрасно экспрессирующую чужеродные гены, либо одноклеточные водоросли, которые остаются одними из самых многообещающих продуцентов биотоплива, поскольку способны к фотосинтезу и для их роста требуется поразительно мало ресурсов.
Воскрешение мамонта? Проект знаменитого американского биохимика и генетика Джорджа Черча по «оживлению» мамонта — один из самых впечатляющих в области синтетической биологии. Черч планирует отредактировать эмбрион слона так, чтобы из него выросло существо хотя бы с некоторыми чертами мамонта (длинная густая шерсть, повышенное жироотложение на холке). Об этом проекте недавно было рассказано в документальном фильме «Генезис 2.0», который сняли совместно швейцарский и российский режиссеры — Кристиан Фрай и Максим Абугаев.
В заключение приведем известную фразу нобелевского лауреата и популяризатора науки Ричарда Фейнмана: «Что я не могу создать, то я не понимаю». Возможно, подлинное понимание устройства биологических систем будет достигнуто вместе с прогрессом в синтетической биологии, когда ученые смогут не только описывать биологические объекты как сторонние наблюдатели, но и создавать либо изменять их.
|
1912 |
Стефан Ледук ввел термин «синтетическая биология». |
|
1961 |
Франсуа Жакоб и Жак Моно описывают регуляцию генов лактозного оперона — простейшего генетического регуляторного элемента. |
|
1970–1980 |
Созданы основные методы генной инженерии. |
|
1977 |
Аллан Максам и Уолтер Гилберт параллельно с Фредериком Сенгером изобрели первые способы секвенирования нуклеиновых кислот. |
|
1983 |
Появилась первая база данных последовательностей ДНК GenBank. |
|
1990 |
Начало проекта «Геном человека». |
|
1999 |
Тимоти Гарднер, Чарльз Кантор и Джеймс Коллинз создали первый искусственный генетический триггер в кишечной палочке. |
|
2000 |
Майкл Эловитц и Станислас Лейблер создали искусственный генный осциллятор в бактерии. |
|
2001 |
Рон Вейс и Том Найт создали первую генетическую сеть, включающую систему кворума (система коммуникации бактерий). |
|
2003 |
Том Найт представил стандарт BioBrick. |
|
2003 |
В Институте Крейга Вентера получили первый синтетический вирус — бактериофаг PhiX 174. |
|
2003 |
Джей Кислинг создал первый искусственный метаболический путь (ряд последовательных химических реакций, катализируемых ферментами, цель которых — получение определенного вещества) в кишечной палочке. |
|
2004 |
В Массачусетском технологическом институте состоялись первый конкурс iGEM (International Genetically Engineered Machine Competition) и первая конференция по синтетической биологии — SB1.0. |
|
2004 |
Том Найт и Дрю Энди создали открытую коллекцию деталей для искусственных биологических систем (Registry of standard biological parts). |
|
2005 |
Том Найт, Дрю Энди и Рэнди Реттберг основали BioBricks Foundation — общественную благотворительную организацию, поддерживающую открытое и этичное развитие биотехнологий по всему миру. |
|
2008 |
Первый синтетический геном бактерии Mycoplasma genitalium JCVI-1.0. |
|
2010–2016 |
В Институте Крейга Вентера созданы бактерии с сокращенными геномами, от JCVI-syn1.0 до JCVI-syn3.0. |
|
2014 |
Синтезирована одна из 16 хромосом пекарских дрожжей Saccharomyces cerevisiae — первая синтетическая эукариотическая хромосома. |
|
2014 |
В Институте Скриппса создали первую бактерию, использующую расширенный генетический код — шесть нуклеотидов вместо четырех (см. «Химию и жизнь» 2014 №7). |
Эта статья доступна в печатном номере "Химии и жизни" (№ 9/2019) на с. 32 — 38.
