Предсказания элементов: успехи и неудачи
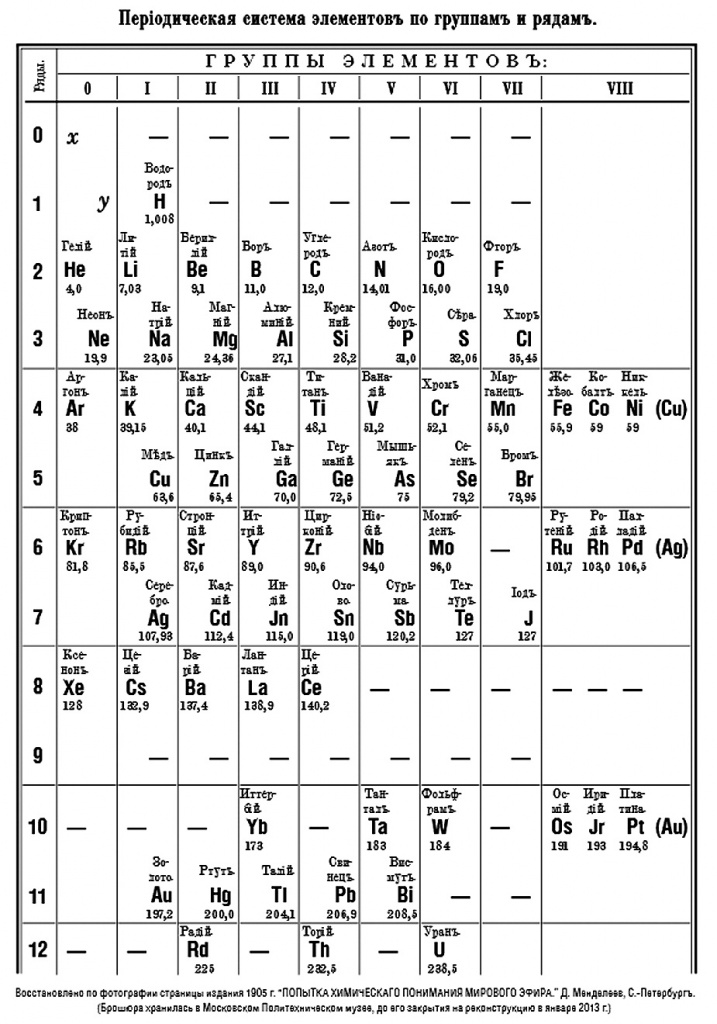
Организация Объединенных Наций провозгласила 2019 год Международным годом Периодической таблицы химических элементов, потому что в этом году исполняется 150 лет со дня создания этой таблицы Дмитрием Ивановичем Менделеевым. Ее можно найти в любом школьном учебнике химии, на каком бы языке он ни был издан, на стенах кабинетов химии и даже на стене одного из зданий на Московском проспекте в Петербурге. В этом здании раньше находилась Палата мер и весов, которой заведовал Менделеев, а сейчас в нем расположен Институт метрологии имени Д.И.Менделеева (рис. 1). Рядом с таблицей — памятник Менделееву (он сидит в кресле). Мозаичное панно создано в 1935 году и отражает уровень знаний того времени. На таблице красным цветом изображены элементы, которые были известны Менделееву (их 71), а синим — элементы, открытые уже после Менделеева и известные к началу 1930-х годов (их в таблице 18). В 8-м ряду изображен элемент иллиний (символ Jl), открытие которого позже было признано ошибкой; сейчас клетку 61 занимает искусственно полученный в 1945 году радиоактивный элемент прометий. Можно также отметить, что на этом панно, на месте современной прописной буквы I, стоит буква J (индий, иод) и что по ошибке мастера буква D в символе диспрозия в 9-м ряду изображена зеркально.
 |
| Рис. 1 |
Авторы книги «100 химических мифов» отдают должное Менделееву, его интуиции и уверенности в своей правоте. Ведь он описывал свойства неизвестных элементов, когда многие химики считали, что уже открыты почти все химические элементы! Хотя аналогичные таблицы предлагали и другие химики, лишь Менделеев осмелился не только предсказать открытие новых элементов, но и указать их место в таблице и даже их физические и химические свойства. Потому что он понимал, что периодическая таблица — не просто удобный способ систематики, а закон природы. Суть этого закона он знать не мог, поскольку строение атомов и, в частности, их электронных уровней стало известно значительно позже.
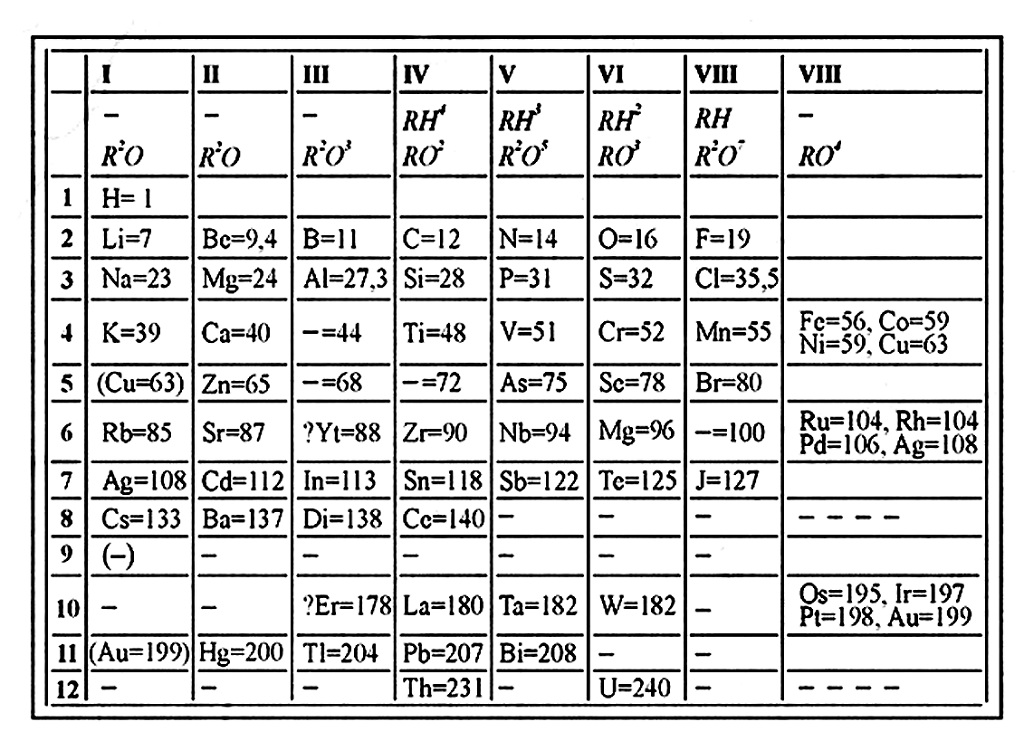
В качестве примеров обычно приводят предсказания и свойства экабора — элемента № 21 (скандий), экаалюминия — элемента № 31 (галлий) и экакремния — элемента № 32 (германий); на санскрите «эка» — один. В первой таблице (1869) (рис. 2) на месте этих элементов стоит не только прочерк, но и указан их предположительный атомный вес. Который, в общем и целом, подтвердился: Sc = 44,96; Ga = 69,72; Ge = 72,61. В течение двух десятилетий после первых предсказаний эти элементы действительно были открыты: галлий — в 1875 году (Поль Лекок де Буабодран), скандий — в 1879м (Ларс Нильсон), германий — в 1886м (Клеменс Винклер). Интересно, что все они имеют «патриотические» названия. Реже упоминают о том, что в первой таблице Менделеев оставил еще одно место для элемента с предположительным атомным весом 100. Он назвал его экамарганцем; этот элемент был получен искусственно только в 1937 году, а массовые числа самых долгоживущих его изотопов 97Тс, 98Тс и 99Тс действительно близки к 100.
 |
| Рис. 2 |
С момента первых предсказаний 1869 года Менделеев сделал в последующие десятилетия немало других. Многие из них блестяще подтвердились. Так, к экамарганцу добавился тримарганец — элемент № 75, рений, открытый в 1925 году (Ида и Вальтер Ноддак). Этот элемент до его открытия часто называли также двимарганцем (на санскрите «дви» — два). Подтвердились также предсказанные Менделеевым двителлур — элемент № 84, полоний (открыт в 1898 году Марией и Пьером Кюри), двицезий (он же экацезий) — элемент № 87, франций (открыт в 1939 году Маргаритой Перей) и экатантал — элемент № 91, протактиний (открыт в 1913 году Казимиром Фаянсом и Освальдом Гёрингом).
К моменту опубликования первого варианта таблицы ранней весной 1869 года не был известен ни один благородный газ, и предсказать их существование тогда было вряд ли возможно. Как писал Менделеев, группу, которая соответствует аргону и его аналогам, «невозможно было предвидеть при том состоянии знаний, какое было при установке в 1869 году периодической системы». Понятие же атомных номеров, которые однозначно расставляли элементы по своим местам, появилось только в 1913 году, в результате работ Генри Мозли. Однако еще при жизни Менделеева стало понятно из его таблицы, что между галогенами и щелочными металлами есть «промежуток», в который, в принципе, можно поместить еще одну колонку (группу) элементов. Поэтому когда в 1894 году был открыт аргон, в 1895м — «земной» гелий, а в 1898м — неон, криптон и ксенон, место в таблице для них уже имелось. В последнем прижизненном (восьмом) издании «Основ химии» (С.Петербург, 1906. Типолитография М.П.Фроловой, Галерная улица, № 6) все известные к тому времени благородные газы (их тогда называли инертными) помещены в нулевую группу (рис. 3). Как написал в своей работе «Периодическая система элементов. История в таблицах» (1992) известный историк химии Дмитрий Николаевич Трифонов, «впервые идея нулевой группы была высказана 5 марта 1900 года на заседании Бельгийской академии наук Л.Эррерой». Через две недели об этом же сообщил Менделееву шотландский химик Уильям Рамзай, лауреат Нобелевской премии по химии за 1904 год за открытие благородных газов (тогда их называли инертными): “Если же считать аргон и его спутников (гелий и пр.) за самостоятельные химические элементы, то их... должно поместить в особую группу, так сказать нулевую, предшествующую группе I... Такое соображение, отвечающее тому, что мне лично было высказано Рамзаем (19 марта 1900 года), находится в согласии с тем, что аргон и его аналоги содержат по одному атому в частице”» («Основы химии», 1906).
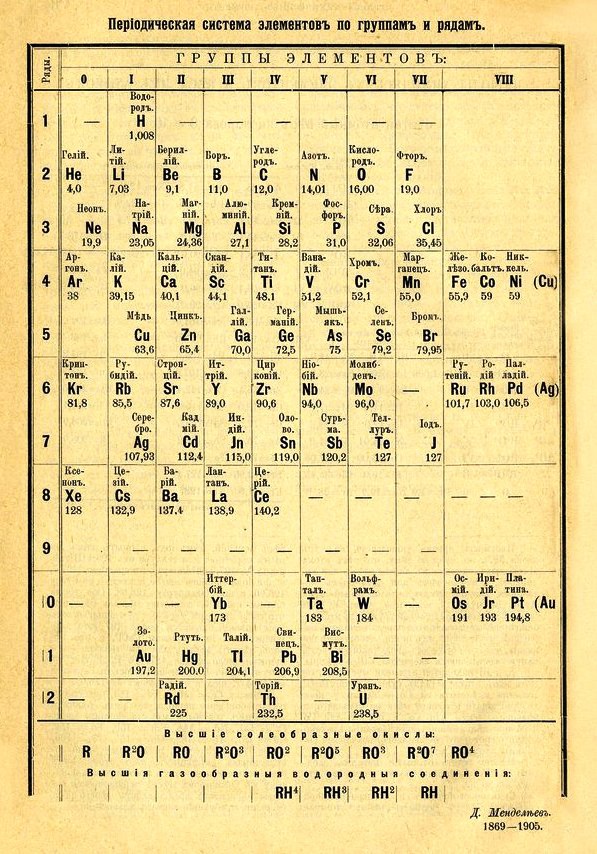 |
| Рис. 3 |
Сложности с размещение в периодической таблице были и с редкоземельными элементами — лантаноидами. Непросто было разделить химически очень похожие элементы. Ко времени создания периодической системы были известны лишь церий (открыт в 1803 году), лантан (1839) и эрбий (1843). В одном из первых (1871) вариантов таблицы, помимо пропусков и вопросительных знаков, помещен элемент «Di = 138», то есть «дидимий» (рис. 4).
 |
| Рис. 4 |
Лишь в 1882 году было показано, что это не индивидуальный элемент, а смесь празеодима и неодима с примесью самария. При жизни Менделеева были открыты также иттербий (1878), тулий и гольмий (1879), гадолиний (1880), диспрозий (1886) и европий (1901). Неудивительно, что Менделеев писал о расположении в своей таблице лантаноидов: «Тут мое личное мнение еще ни на чем определенном не остановилось, и тут я вижу одну из труднейших задач, представляемых периодической законностью». Лантаноиды были вынесены в отдельную строку под основной таблицей только в 1920х годах.
Мало кто знает, что Д.И.Менделеев сделал на самом деле 16 предсказаний существования разных элементов. Авторы книги о химических мифах приводят таблицу всех таких предсказаний, в том числе и не подтвердившихся.
Если не считать эфир и короний (о них речь ниже), остальные шесть не подтвердившихся предсказаний связаны с тем, что Менделеев знал о существовании лантаноидов, но при его жизни было непонятно, какое место они должны занять в таблице элементов. Авторы книги делают неожиданный, но справедливый вывод: в то время как подтвердившиеся предсказания сыграли очень важную роль в признании и принятии химиками всего мира Периодической системы Д.И.Менделеева, не подтвердившиеся предсказания не имели никаких отрицательных последствий для науки! Неудачные предсказания на самом деле имели под собой для Менделеева логические основания, но реальность оказалась несколько иной — что стало ясно только с появлением квантовой теории строения атомов, которая математически точно разместила все химические элементы (в том числе и неоткрытые) по своим местам. Уместно привести несколько заключительных строк, которыми заканчивается в книге «100 химических мифов» глава о предсказаниях новых элементов: «Не бывает непогрешимых людей, но ошибки Менделеева простительны и фактически забыты учеными, потому что его вклад в химию был, по существу, гигантским. Из всех ученых, именем которых были названы химические элементы, Менделеев заслужил такую честь прежде всего». Название «менделевий» для элемента № 101 было предложено не отечественными химиками, а группой американских ученых.
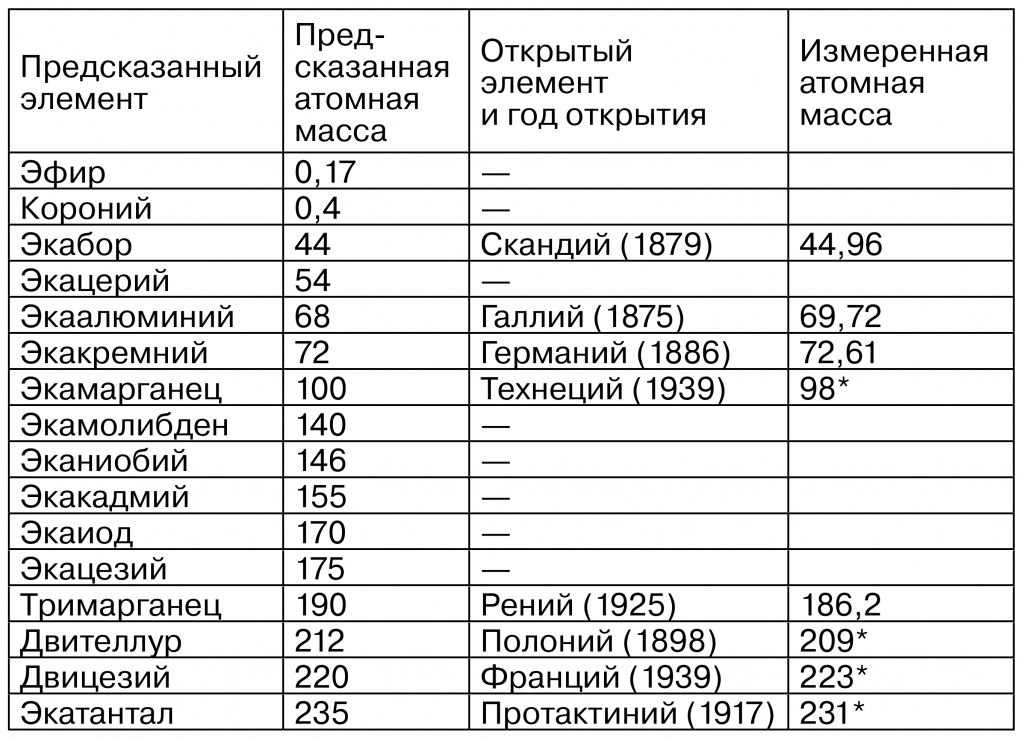 |
| * Приведены массовые числа наиболее долгоживущих изотопов. |
Но при чем тут мифы? Довольно распространенный до сих пор миф связан с одним из ошибочных предсказаний Менделеева: некие враги якобы сфальсифицировали периодическую таблицу. Вот типичная цитата из Интернета: «Основной политический смысл эйнштейновского учения состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире... То, что сейчас преподносят в школах и университетах под названием “Периодическая система химических элементов Д.И.Менделеева”, — откровенная фальшивка». Речь идет об элементах легче водорода, «открытых» Менделеевым и коварно утаенных врагами. Давайте разберемся, что за история с этими элементами.
В 1902 году Д.И.Менделеев написал статью «Попытка химического понимания мирового эфира». Эта статья была опубликована в виде отдельной брошюры в 1905 году. Она воспроизведена (с современной орфографией) в книге «Д.И.Менделеев. Периодический закон. М.: АН СССР, 1958». Приведем выдержки из этой статьи.
«<В 1869 году> у меня мелькали мысли о том, что раньше водорода можно ждать элементов, обладающих атомным весом менее 1, но я не решался высказываться в этом смысле по причине гадательности предположения и особенно потому, что тогда я остерегся испортить впечатление предполагавшейся новой системы, если ее появление будет сопровождаться такими предположениями, как об элементах легчайших, чем водород. Теперь же, когда стало не подлежать ни малейшему сомнению, что пред той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньшие, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более легких, чем водород. Из них обратим внимание сперва на элемент 1го ряда 0й группы. Его означим через y. Ему, очевидно, будут принадлежать коренные свойства аргоновых газов. Но прежде всего следует получить понятие о его атомном весе. Для получения приближенного понятия о нем обратимся к изменяющемуся отношению между весами атомов двух элементов той же группы из соседних рядов... Должно полагать, что отношение He : y будет значительно более отношения Li : H, а это последнее = 6,97, следовательно, отношение He : y будет по крайней мере = 10, а вероятно, что оно будет еще значительнее. А потому, так как атомный вес He = 4,0, то атомный вес y будет не более 4,0/10, то есть не более 0,4, а вероятно, что еще менее этого. Таким аналогом гелия, быть может, должно счесть короний... <Поэтому> коронию надо приписать меньший вес атома и меньшую плотность, чем водороду… Но все же этот y, то есть короний или иной газ с плотностью около 0,2 — по отношению к водороду, не может быть никоим образом мировым эфиром... Этот элемент y, однако, необходим для того, чтобы умственно подобраться к тому наилегчайшему, а потому и наиболее быстро движущемуся элементу x, который, по моему разумению, можно считать эфиром… Задача о мировом эфире, более или менее тесно связанная с задачею тяготения, делается проще, когда от нее совершенно отнять вопрос о химическом притяжении атомов эфира, а, помещая его в нулевую группу, мы этого и достигаем. Но в этой группе, за элементом y, не остается места для еще более легкого элемента, каким и надо представить эфир, если ряды элементов начинать с 1го, то есть с того, где водород. Поэтому я прибавляю в последнем видоизменении распределения элементов по группам и рядам не только нулевую группу, но и нулевой ряд, и на место в нулевой группе и в нулевом ряде помещен элемент x (мне бы хотелось предварительно назвать его “ньютонием” — в честь бессмертного Ньютона), который и решаюсь считать, во-первых, наилегчайшим из всех элементов, как по плотности, так и по атомному весу, во-вторых, наибыстрее движущимся газом, в-третьих, наименее способным к образованию с какими-либо другими атомами или частицами определенных сколько-либо прочных соединений, и в-четвертых, — элементом, всюду распространенным и все проникающим, как мировой эфир».
«Не представляя себе возможности сложения известных элементов из водорода, я не могу считать их и сложенными из элемента x, хотя он легче всех других… Задачу тяготения и задачи всей энергетики нельзя представить реально решенными без реального понимания эфира, как мировой среды, передающей энергию на расстояниях. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности... Судить по аналогам гелия о малом атомном весе x нельзя уже потому, что точность известных здесь чисел очень невелика, дело же идет, очевидно, об очень малом весе. Однако если заметить, что отношение атомных весов Xe : Kr = 1,56 : 1, Kr : Ar = 2,15 : 1 и Ar : He = 9,50 : 1, то по параболе 2го порядка найдем, что отношение Не : x = 23,6 : 1, то есть если He = 4,0, величина атомного веса x = 0,17, что должно считать за наивысшую из возможных величин. Гораздо вероятнее принять вес атома x еще во много раз меньший... Вес атома x газа должен быть менее 0,038, чтобы газ этот мог свободно вырываться из земной атмосферы в пространство. Газы с большим атомным весом, следовательно, не только водород и гелий, но и газ y (короний?), могут оставаться в земной атмосфере… Я полагаю, что для понимания множества явлений совершенно достаточно признать пока, что частицы и атомы легчайшего элемента x, могущего свободно двигаться всюду, имеют вес, близкий к одной миллионной доле веса водородного атома, и движутся со средней скоростью, недалекою от 2250 километров в секунду».
Менделеев помещает в брошюре таблицу элементов, которая включает эти два предполагаемых элемента х и у (рис. 5). А в конце статьи он все же подчеркивает их гипотетичность: «Я и смотрю на свою далекую от полноты попытку понять природу мирового эфира с реально химической стороны не более, как на выражение суммы накопившихся у меня впечатлений, вырывающихся исключительно лишь по той причине, что мне не хочется, чтобы мысли, навеваемые действительностью, пропадали. Вероятно, что подобные же мысли приходили многим, но, пока они не изложены, они легко и часто исчезают и не развиваются, не влекут за собой постепенного накопления достоверного, которое одно сохраняется. Если в них есть хоть часть природной правды, которую мы все ищем, попытка моя не напрасна, ее разработают, дополнят и поправят, а если моя мысль неверна в основаниях, ее изложение, после того или иного вида опровержения, предохранит других от повторения. Другого пути для медленного, но прочного движения вперед я не знаю». Осторожность и самокритичность Менделеева типична для великого ученого.
 |
| Рис. 5 |
Представляют интерес некоторые из многочисленных примечаний к этой статье, в которых Менделеев пытается чисто теоретически развить положения «эфирной гипотезы». «Мне кажется мыслимым, что мировой эфир не есть совершенно однородный газ, а смесь нескольких, близких к предельному, то есть составлен подобно нашей земной атмосфере из смеси нескольких газов. Но, допустив это, мы бы усложнили еще более рассмотрение предмета, а потому, ради упрощения, я говорю далее лишь об однородном предельном газе, могущем представлять собою свойства, принадлежащие эфиру».
«Быть может, возможны также элементы с атомными весами большими, чем у H = 1,008, но меньшими, чем у He = 4... Рассмотрение иных возможных элементов из числа более легких, чем гелий, но тяжелейших, чем водород, вовсе не касается предмета этой статьи. Быть может, галоид с атомным весом около 3 найдется в природе».
«Не думаю, что тут лежит грань познания на веки вечные, но полагаю, что ранее понимания массы должно вырабатывать реально-ясное понимание эфира. Если бы моя “попытка” повела к такой выработке, хотя бы совсем с иной стороны, моя решимость выступить с желанием реально понять эфир была бы оправдана законами истории поступательного движения знаний, то есть искания истины».
В итоге Менделеев не решился включить элементы х и у («ньютоний» и «короний») в таблицы элементов, помещенные в 7-м (1903) и 8-м (1906) изданиях «Основ химии», ограничившись общими рассуждениями. Так, в предисловии к 7-му изданию он пишет:
«Чем более приходилось думать о природе химических элементов, тем… яснее сознавал, что ранее того или сперва должно получить более реальное, чем ныне, представление о «массе» и об «эфире»… Чтобы идти далее в познании самих атомов, неизбежно выяснить опытным путем исходные понятия о массе, о притяжении и об «эфире», иначе реализм опять сам откроет двери метафизическим и метахимическим представлениям, подобным флогистону и разным мистическим бредням... Располагая элементы по группам и рядам периодической системы и видя, что, кроме групп I —VIII, для аналогов аргона должно признать нулевую группу, можно полагать, что есть и нулевой ряд элементов, более легких, чем водород и даже в ряде водорода элемент нулевой группы. Элемент же нулевого ряда и нулевой группы должен быть во много раз легче водорода по весу атома; назовем этот вес x. Это должен быть несжимаемый газ, и плотность по отношению к водороду — при одинаковых условиях — должна быть = x/2, т. е. в его частице будет один атом, как у гелия, аргона и т. п. Чрезвычайно малая плотность газа, т. е. чрезвычайная быстрота собственного движения его частиц — при ничтожном весе их, равно как и положение в нулевой группе, должно влиять на то, что газ этот везде проникнет, будет наполнять вселенную, но ни к чему прочно не примкнет — для согласного движения в химическом соединении, т. е. он нигде не скопится. Такие же воображаемые свойства должно иметь и вещество «эфира». Стараясь придать понятию об «эфире» химическую, а потому и реальную возможность, согласованную с чисто-реальным периодическим законом, я полагаю, что посильно служу единству естествознания, составляющую залог его силы».
Читателю, знакомому с теорией строения атома, не надо объяснять, что элементов с массой менее чем у водорода не существует, как и эфира. А сам Менделеев в предисловии к последнему прижизненному (8му) изданию прямо предупреждает: «При всем стремлении к объективности изложения науки, в нем всегда и неизбежно будет содержаться немало субъективно-личного и временного».
Эта статья доступна в печатном номере "Химии и жизни" (№ 7/2018) на с. 22 — 25.
