Цинк: факты и фактики
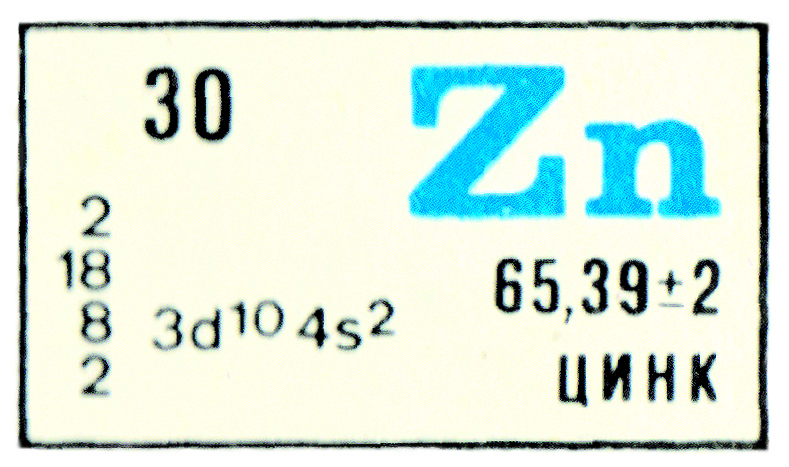
Кто первым получил металлический цинк? Ответить на этот вопрос непросто. Цинк как таковой начали использовать в древнейшие времена для легирования меди и получения латуни. Однако считается, что в сплав его вводили не как металл, а добавляли руду, из которой цинк восстанавливался в процессе выплавки. Сведения же про первый металлический цинк крайне противоречивы. Есть мнение, что плавить цинк стали в Древнем Риме, при этом ссылаются на упоминания у Страбона о том, что в руде с Кипра содержится «кадмиевый камень, медный витриол и тутиа», и из этой руды можно изготовлять бронзу, по цвету неотличимую от золота. Сейчас мы знаем, что это латунь — сплав меди с цинком, и как раз при Августе, то есть в I веке нашей эры, когда жил Страбон, римляне начали плавить бронзу. (Откуда они брали бронзу для своего непобедимого оружия предшествующие три сотни лет, историки не очень распространяются.) Есть исторические сведения, что цинк длительное время, с XII по XVI век, плавили в индийском Раджастане. Там, в районе Завара, находят и остатки оборудования, и отходы производства цинка и его оксида. По отходам объем добычи металла оценивают в миллион тонн. Сохранился даже трактат XIV века, в котором описан процесс выплавки.
В XVI веке центр производства цинка перемещается в Китай, где открытая внешнему миру династия Мин как раз сменила монгольскую Юань. Минский Китай на полтора столетия становится основным поставщиком на мировой рынок цинка в качестве сырья для изготовления латуни. Потом эстафету перенимают Англия, Бельгия и Пруссия.
Однако имеются сведения, которые противоречат этой истории: изредка археологи находят древние цинковые артефакты, и отнюдь не в Индии. Например, встречаются упоминания о цинковой статуэтке в слое земли, соответствующей доримской Дакии. В «Химии и жизни» (1968 №3) знаменитый ныне раскопками в Каргалы археолог Е.Н.Черных, а тогда кандидат исторических наук, рассказывал о находке цинковой подвески в местечке Мешоко на Северном Кавказе: ее возраст — 3000 лет до нашей эры! Получается, что человечество не единожды узнавало и утрачивало секрет выплавки этого металла.
Почему цинк трудно получать? Минералы цинка в чистом виде встречаются редко, они, как правило, входят в состав полиметаллических руд. Наиболее распространенный минерал — сфалерит, или цинковая обманка, содержащий сульфид. (Свое название минерал получил из-за того, что имеет множество обличий.) Впрочем, с древности цинк получали из отхода производства серебра и свинца — оксидного минерала каламина. Для восстановления металла из оксида, например железа или меди, минерал надо бросить в костер, там уголь отнимет кислород, и чистый жидкий металл потечет из огня к ногам удачливого металлурга. Но с цинком этот прием не работает. Дело в том, что он плавится уже при температуре 419°С, а кипит при 906°С. Поэтому, восстановившись, цинк не вытекает из огня, а возгоняется. Пар реагирует с кислородом воздуха, и снова получается оксид цинка. Эту особенность заметили персы: они делали оксид цинка, а называли его тутиа (да-да, так, как римлянин Страбон за 1500 лет до того называл минерал цинка), что буквально означает «белый дым». Поэтому для получения металла его пар надо поймать и отвести в конденсатор, причем в бескислородной атмосфере, то есть в герметически закрытой системе. Средневековые мастера Азии это знали. Например, индусы набивали смесь руды с шерстью в реторту высотой 25 см, диаметром 15 см, переворачивали ее вверх дном в печке и короткой трубкой соединяли с сосудом, который стоял ниже, на воздухе. Реторту обкладывали горючим и поджигали. Тяжелый пар цинка уходил вниз и конденсировался. Китайцы ставили в печь батареи закрытых глиняных тиглей с каламином и углем, перекладывали тигли углем, поджигали, доводили до красного каления, а потом охлаждали. В середине каждого тигля получался слиточек цинка.
В Европе путь к металлическому цинку был тернистым и запутанным. Так, в XV веке Парацельс отметил, что цинкум, который изготавливают металлурги в Силезии, — несомненно, новый, восьмой по счету металл после издревле известных золота, серебра, меди, железа, олова, свинца и ртути. Обычно комментаторы отмечают проницательность Парацельса, однако гораздо интереснее тот факт, что жители Силезии, оказывается, умели получать цинк и что-то из него делать задолго до того, как его признала наука. В XVI веке европейские ученые свои поиски восьмого металла еще продолжали: Агрикола писал, что белый металл конденсируется на стенках печей, в которых плавят свинцово-серебряную руду из Раммельсберга. Он назвал этот металл контрафактом (contrefey), поскольку его использовали для подделки золота — видимо, вслед за древними римлянами получая золотистую латунь. Тем не менее считается, что плавить цинк в средневековой Европе не умели; его привозили из Азии португальцы, голландцы и арабы, причем последние так и называли металл по месту происхождения — «кхарсин», то есть «металл из китайских шахт». Европейцы же его называли «спелтер» — как отмечает историк Фатхи Хабаши из Международной цинковой ассоциации, он был похож на оловянно-свинцовый сплав пьютер, поэтому применили схожее слово.
В середине XVIII века исследователи по всей Европе озаботились созданием технологии плавки цинка. И вот в 1740 году англичанин Уильям Чемпион съездил в цинский Китай, а через три года в Бристоле была запущена цинковая фабрика. Там применяли способ, напоминавший индусский, — печь с перевернутыми вверх дном ретортами, только гораздо большего размера. Примерно тогда же, в 1742 году, шведский химик Антон фон Шваб получил цинк возгонкой из импортной руды, а в 1752-м, выполняя госзаказ, он и Алекс Фридрих Кронштедт придумали, как получать цинк из шведских руд. В 1746 году немецкий химик Андреас Маргграф, анализируя руды из Польши, Англии, Венгрии, научился и из них добывать цинк. Неясно, связана ли эта исследовательская активность со стремлением маньчжуров ограничить внешнюю торговлю Китая в период Цин или с тем, что импортный металл перестал удовлетворять запросы промышленности в эпоху индустриализации.
Но вот в 1798 году в Верхней Силезии Йохан Рутберг строит первую печь с горизонтальными ретортами, где можно получать много цинка из любой руды, и Европа становится основным изготовителем этого металла вплоть до 1907 года, когда вперед выходят США. В XX веке пирометаллургический способ стал уступать электролизу.
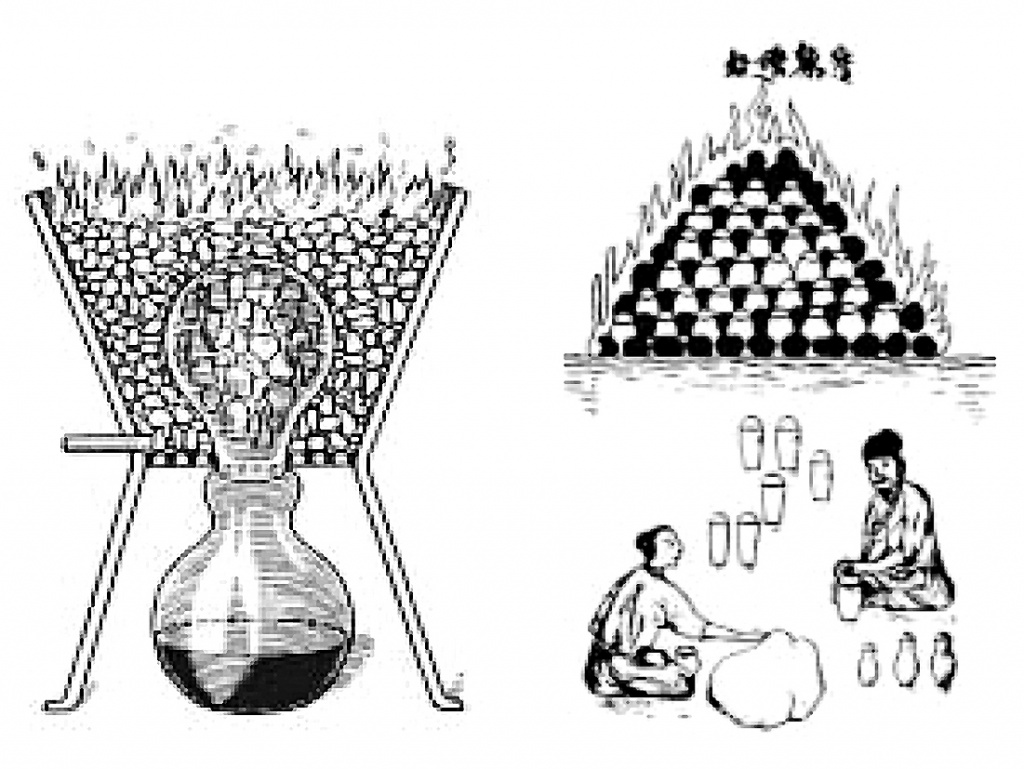 |
| У индусов пар цинка конденсировался, уходя вниз из нагретой реторты (слева), а у китайцев получался при остывании запечатанных глинянных сосудов, заполненных цинковым минералом и углем (справа) |
Зачем нужен цинк? Во-первых, это сырье для производства латуни. А латунь — важнейший сплав для точного машиностроения: помимо того что из нее легко получать отливки, она отличается от стали коррозионной стойкостью, мало уступая ей в прочности. Поэтому всевозможные вентили и клапана — а без них паровая машина не заработает, — кроме как из латуни, сделать не из чего. Иными словами, без цинка развитие машинного производства стало бы весьма затруднительным.
Во-вторых, цинк — один из самых дешевых металлов, дешевле только железо и свинец. Но по коррозионным свойствам он превосходит первое, а по прочностным — второй. Поэтому когда в Бельгии в 1815 году запустили первый стан для прокатки цинковых листов, цинк начали использовать как кровельный материал вместо дорогой меди. Кстати, мировая промышленность до сих пор изготавливает цинковую металлочерепицу и облицовочные панели для фасадов зданий. При толщине менее одного миллиметра такая крыша прослужит более ста лет. Ее характерная черта — серый цвет. Еще дешевле нанести цинковое покрытие на сталь: почти половина цинка идет на производство оцинкованного железа. Его роль здесь необычна — в отличие от никеля или краски цинк не просто защищает железо от контакта с водой. В ряду активности металлов он стоит за железом, то есть первым вступает в химическую реакцию — принимает удар на себя. В результате же реакции с водой и углекислым газом воздуха получается нерастворимое вещество — гидрокарбонат цинка. Он дополнительной прочной пленкой защищает поверхность оцинкованного изделия. Интересно, что какое-нибудь оцинкованное ведро легко сделать разноцветным в домашней лаборатории без использования красок (см. статью «Как раскрасить ведро» в этом номере).
 |
| Из цинка делают листы и для кровали, и для облицовки стен. Класть цинковую кровлю надо на мягкую подложку (показана стрелкой) |
Что такое серебряная пена? Есть интересный способ выделения драгоценных металлов. Их зачастую получают из руд, содержащих свинец, медь, цинк. В процессе переработки золото и серебро оказываются в так называемом черновом свинце. Чтобы извлечь их, на него наливают расплавленный цинк. Растворимость драгоценных металлов в нем гораздо выше, и они покидают свинец. Но, кроме того, они образуют с цинком интерметаллиды, а их температура плавления, как правило, весьма велика. Закристаллизовавшись, эти соединения создают на поверхности расплавленного цинка серебристую драгоценную пену. Ее снимают и пускают на дальнейшую переработку (см. «Химию и жизнь» 1972 №6).
Зачем цинк в краске? Есть две широко распространенные краски с цинком. Первая — краска серого цвета на основе цинковой пыли. Эта пыль сама собой образуется при конденсации паров цинка. При окрашивании железной поверхности цинк вступает с ней в химическое взаимодействие, прочно присоединяя пылинку. Возникает антикоррозионный эффект, примерно такой же, как у оцинкованной поверхности. Именно поэтому многие металлоконструкции, например элементы мостов, окрашены в серый цвет. А если в краску добавить оксид цинка, то она станет белой — это знаменитые цинковые белила.
Какие еще есть важные соединения цинка? Селенид и сульфид цинка хорошо пропускают инфракрасное излучение. Желтые кристаллы селенида отлично работают в той области спектра, которой соответствует излучение лазеров на углекислом газе. Это мощные технологические лазеры, применяемые для резки материалов и сварки металлов. Именно из селенида цинка делают выходные окна таких лазеров. Сульфид цинка интересен в другом отношении: он пропускает как видимый свет, так и инфракрасный в диапазонах прозрачности атмосферы. Из него делают окна тепловизоров, а также оружейных прицелов, если нужно использовать видимый и инфракрасный диапазоны. Другое важное свойство сульфида цинка — способность к люминесценции. Именно с помощь экрана из этого вещества Резерфорд открыл сложное строение атома. Сульфид цинка применяли для изготовления светящегося слоя на экране электронно-лучевой трубки телевизора, и его до сих пор применяют в экранах осциллографов.
Что такое цинк-воздушные аккумуляторы? С давних времен с помощью цинка получают электричество. Первый гальванический элемент состоял из чередующихся пластин меди и цинка. Затем цинк стал электродом в многочисленных батарейках. Цинк-воздушный аккумулятор представляет собой скорее топливный элемент, чем электрический аккумулятор, — электроэнергию он не накапливает, а производит за счет окисления цинка кислородом воздуха. Поскольку вторым электродом фактически служит воздух, освобождается много места; такой элемент вырабатывает гораздо больше энергии в расчете на единицу веса.
Цинк-воздушные элементы с переменным успехом применяют со времен начала электрификации. Еще Эдисон использовал их для питания железнодорожной сигнализации. Затем они заменили ртутные батарейки в фототехнике. В 90-х годах XX века словенец Миро Зорич, который возглавил программу электрификации Сингапура, сделал ставку именно на такие элементы. В 1997 году он создал фабрику для их массового производства, организовал службу перезарядки элементов (для перезарядки нужно удалить накопившийся оксид цинка и добавить свежий металл). Его усилия привели к тому, что небольшие автобусы в этом городе-государстве используют электрическую тягу.
В перспективных конструкциях цинк-воздушных элементов внутрь реактора постоянно подают пеллеты из цинка, а система очистки так же постоянно убирает из электролита оксид цинка, который после накопления в отстойнике сдают на станцию техобслуживания, а затем на переработку. Увы, идея с такими механически перезаряжаемыми источниками электропитания не встретила понимания у сторонников электротранспорта, они предпочли литиевые аккумуляторы. А ведь запасов цинка гораздо больше, чем лития, их легко хватит на миллиард электромобилей, кроме того, при правильной организации нового цинка нужно совсем немного, большая его часть будет поступать из системы переработки топлива. В сущности, эта идея сходна с пропагандируемым отечественными специалистами алюминиевым топливом для электротранспорта (см. «Химию и жизнь» 2008 №3): алюминий дороже цинка, но его удельное энергосодержание гораздо выше.
У цинк-воздушного элемента есть серьезные недостатки. Начав работать, то есть когда включена подача воздуха, он уже с трудом может остановиться. Другая проблема связана с тем, что в качестве электролита использован водный раствор щелочи: нужно постоянно следить за содержанием воды, чтобы она не испарялась в сухой атмосфере и не накапливалась во влажной. Кроме того, требуется контролировать образование нерастворимых карбонатов из-за присутствия в воздухе углекислого газа. Есть и очевидная проблема с работой элемента на морозе. Попытки создания электрически заряжаемого элемента, в котором оксид цинка восстанавливался бы до металла, пока что успехом не увенчались, в частности, из-за того, что металлический цинк формирует дендриты, которые закорачивают элемент. Не исключено, что, когда подобные проблемы будут решены, цинковые элементы смогут себя проявить в электрификации транспорта как альтернатива литиевым и свинцово-цинковым аккумуляторам.
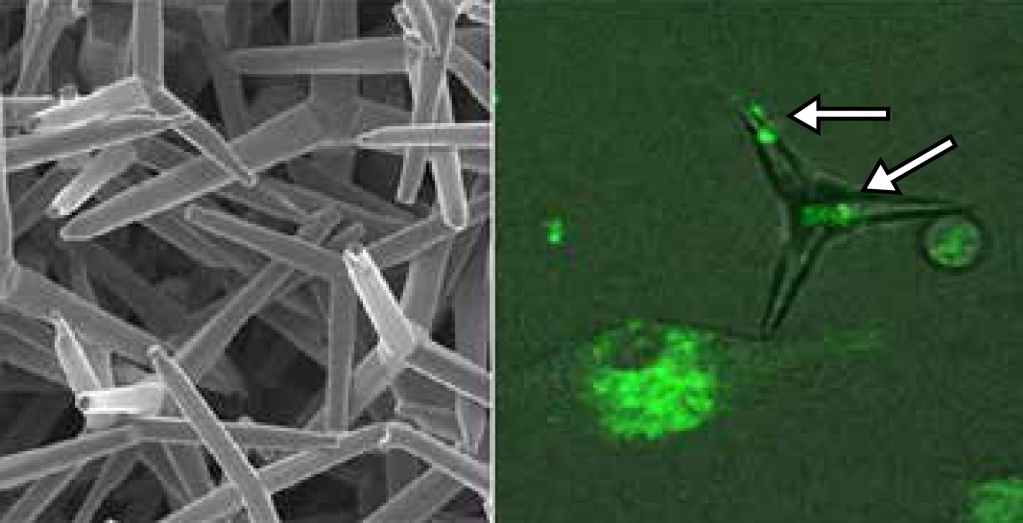
Зачем нужен оксид цинка? Это не только пигмент белой краски, но и древнейшее лекарство. Первое историческое свидетельство о нем в Европу привез Марко Поло, рассказавший, что в Персии делают белую мазь — тутию — из испарений нагретого минерала и используют ее для лечения глазных болезней. Основа этой мази — частицы оксида цинка. До сих пор цинковую эмульсию применяют для лечения прыщиков и прочих кожных болезней, вызываемых микробами. Дело в том, что оксид цинк обладает неплохими бактерицидными свойствами. Бактерицидным свойствам оксида цинка и сегодня ищут новые применения. Например, с помощью ультразвука звездчатые наночастицы оксида диаметром 65 нм синтезируют прямо на хлопковых нитях и получают бактерицидную ткань, которая, естественно, гораздо дешевле, чем ткань с наночастицами серебра. Если использовать при синтезе какую-нибудь смолу, частицы намертво прилипнут к волокнам и не станут отслаиваться при стирке. Такие наночастицы обладают и фотокаталитической активностью, разлагая органические красители, и антимикробной, полностью уничтожая в радиусе 3 мм золотистый стафилококк, кишечную палочку и болезнетворный грибок Candida albicans («Ultrasonics Sonochemistry»). С помощью экстракта из опавших цветков дерева жакаранды мимозолистной и микроволнового облучения получают мельчайшие, диаметром 2—4 нм, наночастицы оксида цинка, прекрасно справляющиеся с кишечной палочкой и фекальным энетерококком («Journal of Photochemistry and Photobiology» B). А немецкие ученые научили частицы оксида цинка бороться с вирусами. Дешевым способом — без использования растворителей, в пламени горелки — они делают четырехрогие наночастицы этого вещества и облучением создают на их поверхности дефекты. К дефектам прекрасно прилипают частицы вирусов, а дендритные клетки иммунной системы почему-то с большой охотой соединяются с наночастицами, опознают вирус и потом предъявляют ее лимфоцитам-убийцам. Таким образом, к антимикробным свойствам наночастиц добавляются и иммуностимулирующие, побочные же эффекты, как свидетельствует тысячелетняя практика использования мазей с оксидом цинка, минимальны. Этот препарат показал свою эффективность при лечении генитального герпеса у животных, и скоро начнутся испытания с участием людей («Journal of Immunology»).
 |
|
Вирусные частицы (светятся на правом фото) оседают на поверхности наночастиц оксида цинка и попадают под прицел клеток иммунной системы («Journal of Immunology», 2016; doi: 10.4049/jimmunol.1502373) |
Лечит ли цинк простуду? Во всем мире с 1984 года идут опыты по лечению простуды с помощью цинка. Механизм его действия на риновирусы не очень понятен, исследователи намекают на антиоксидантные свойства и иммуностимуляцию. Эксперименты же показывают, что у больных, которые в первые сутки после появления симптомов начали сосать леденцы цинкового препарата в таком количестве, что ежедневная доза цинка составляла не менее 75 мг, простуда протекает легче, продолжительность болезни в среднем на два-три дня меньше, а принимать антибиотики пришлось лишь в 4% случаев против 36% в контроле. Основные соединения цинка, которые применяют для такого лечения, — ацетат и глюконат. А вот данные по профилактике простуды с помощью цинковых препаратов противоречивы: как правило, никакого эффекта не замечено. Специалисты отмечают, что действуют именно леденцы, поскольку только так ионы цинка направляются непосредственно в горло и нос, не поучаствовав в химических реакциях. Проглоченные таблетки не подействуют. Кроме того, нужно, чтобы среда во рту была щелочной, иначе цинк потеряет эффективность. И похоже, вкус у этих леденцов оставляет желать лучшего, поскольку некоторые отмечают, что смириться с ним побуждает только желание поскорее выздороветь.
Какова роль цинка в человеческом организме? Эта роль велика, ведь цинк — второй по содержанию металл после железа: в каждом человеке есть 2—3 грамма цинка. История изучения его биологической роли начинается в 1897 году, когда ученик Пастера Жюль Раулин установил, что этот металл необходим черной плесени Aspergillus niger. В 20-х годах ХХ века было измерено содержание цинка в различных тканях, и начались споры: накапливается ли он просто из-за присутствия в пище или выполняет какие-то функции. В 1934 году оказалось, что цинк жизненно важен для крыс, а в 1961-м этот факт установили и для человека. В 1939 году был открыт первый фермент, содержащий цинк, причем именно металл отвечал за его активность. Сейчас известны более полутора тысяч цинксодержащих белков, в том числе три сотни ферментов всех классов. Глядя на расшифрованный геном человека, биоинформатики отмечают, что это не всё: 10% наших белков — почти четыре тысячи — должны содержать цинк.
Естественно задать вопрос, как регулируется обмен цинка в организме. Пока что ответа на этот вопрос нет. В отличие от железа не выявлен главный гормон, который регулирует цинковый метаболизм. Обнаружено 14 транспортных белков, способных переносить цинк в клетку, и 10, которые выводят цинк из нее, но они же могут перетаскивать и другие металлы. Некоторые из этих белков транспортируют цинк через мембраны внутриклеточных органелл. Есть подозрение, что цинк в виде соединений накапливается и в органеллах, и в цитоплазме, а при необходимости его извлекают из хранилищ и используют для синтеза белков. Возможно, и сам по себе ион цинка служит переносчиком каких-то сигналов. Исследование его информационной роли считается очень перспективной областью, сулящей серьезные открытия как в биологии, так и в медицине. Пока выяснено, что при различных воздействиях концентрация свободных ионов цинка в клетке может возрастать двух-трехкратно, а порой и на порядок. Точно известно, что выделяемые из везикул нейронов ионы цинка участвуют в передаче нервного импульса. Кроме того, цинк может замедлять гибель клеток, причем двумя способами: во-первых, как внутриклеточный антиоксидант, во-вторых, как ингибитор фермента, запускающего апоптоз. С другой стороны, в некоторых клетках, например нейронах, цинк способствует апоптозу. В общем, до полного понимания биологической роли этого элемента еще далеко.
Что такое цинковый палец? Это одно из важнейших орудий генных инженеров. История его открытия такова. В 1985 году была расшифрована структура транскрипционного фактора IIIА шпорцевой лягушки Xenopus laevis. Его важной частью оказалась девять раз повторяющаяся последовательность из остатков цистеина и гистидина, связанная с девятью ионами цинка. Этот небольшой белковый фрагмент способен хватать молекулу нуклеиновой кислоты подобно тому, как человеческая рука обхватывает канат. Вскоре был расшифрован геном человека, и в нем нашли более пяти тысяч участков, кодирующих белковые фрагменты, которые повторяют мотив цинкового пальца шпорцевой лягушки. Речь именно о фрагментах, само число белков меньше, так как цинковых пальцев может быть несколько в одном белке (рекорд — 36). Потом выяснилось, что подобные структуры с ионами цинка могут цепляться не только за нуклеиновые кислоты, но и за белки, и даже за некоторые углеводы. Генные инженеры даже создали искусственные нуклеазы с цинковыми пальцами — эти ферменты разрезают молекулу ДНК в нужном инженерам месте; пальцами нуклеазы как раз и держатся за двойную спираль. Они дополняют имеющиеся наборы природных нуклеаз, используемых для тех же целей. Это замечательный инструмент редактирования геномов, с которым конкурирует восходящая звезда CRISPR-Cas9 (см. статью «Дело Криспера» в этом же номере). Более того, дело уже дошло до клинических испытаний: с их помощью редактируют геномы человеческих лейкоцитов, чтобы сделать их неуязвимыми для атаки ВИЧ («Current Gene Therapy»).
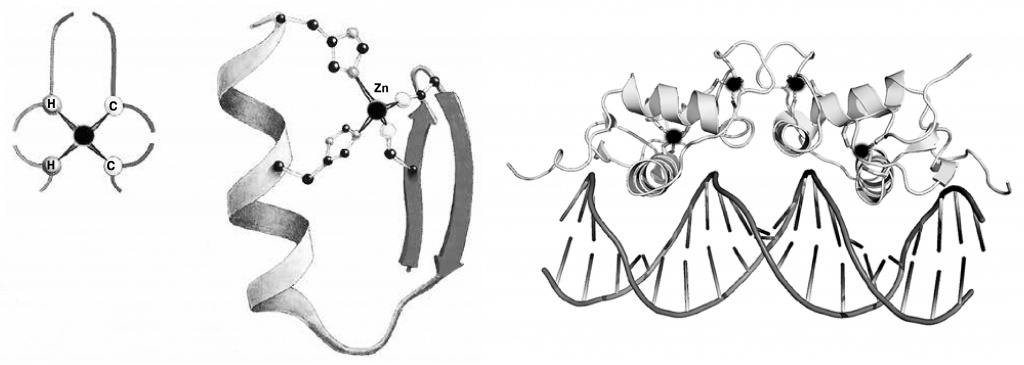 |
| В цинковом пальце атом металла (обозначен черным кружком) связан с двумя остатками гистидина (слева) и двумя остатками цистеина (справа). Белок цинковыми пальцами охватываает молекулу ДНК в нужном месте |
Сколько стоит цинк? Среди цветных металлов цинк на третьем месте по объему производства после алюминия и меди. Сейчас его извлекают из сернокислого концентрата, который сначала обжигом превращают в оксид, а затем с помощью электролиза получают металл. Далее его плавят и отливки отправляют потребителю. Из отходов производства можно извлечь серебро, свинец, германий, кадмий. Напомним (см. «Химию и жизнь» 2013 №9), что из-за повсеместного запрета кадмия его невыгодно извлекать из отходов цинкового производства и этот ядовитый металл сильнее загрязняет окружающую среду.В 2013 году, по данным Британской геологической службы, было получено 13 млн т цинка. Лидеры по добыче руды — КНР (5,2 млн т в пересчете на цинк), Австралия (1,5) и Перу (1,4). Более полумиллиона тонн дают Индия (0,8), США (0,8), Мексика (0,6). Лидеры по выплавке — КНР (5,3 млн т), более полумиллиона тонн дали Южная Корея (0,9), Индия (0,8), Канада (0,7), Япония (0,6), Испания (0,5). В РФ и Казахстане сколько руды добыли (193 и 417 тыс. т), столько примерно цинка и получили (240 и 320 тыс. т). Экономика цинкового производства такова: затраты на энергию весьма высоки, составляют почти половину стоимости, поскольку сырье надо обжечь, а затем подвергнуть электролизу. Лидеры по экономии энергии — Евросоюз: на тонну цинка идет 3,76 МВт.ч электроэнергии и 19,98 ГДж полной энергии, затем Норвегия и Намибия (4,5/16,31 и 4,6/16,59 соответственно). А в РФ и Казахстане — 4,44/31,35 и 4,6/37,85. При этом цены на электричество в РФ и ЕС практически равны — 56,2 и 58,9 евро на МВт⋅ч , а вот в Казахстане — 18,9. В результате по затратам энергии наш цинк один из самых дорогих и уступает только китайскому, да и то слегка. Стоимость труда в РФ и Казахстане почти равны и вчетверо меньше, чем в ЕС, — 7 и 28 евро за час работы. В Намибии труд стоит дороже — 11 евро в час, а в КНР намного дешевле — 2,4 евро. Производительность труда также сильно различается: на одного рабочего в ЕС приходится изготовление 341 т цинка, в Казахстане — 123 т, а в КНР и РФ — 86 и 81 т. Лидер же — Норвегия, где на одного работника приходится 535 т цинка. Но вот что удивительно: сумма затрат на оплату труда и прочие расходы на наших заводах самые высокие — почти 350 евро за тонну металла, что на 100 евро больше, чем в ЕС или Казахстане. В итоге наш цинк оказывается самым дорогим — около 650 евро за тонну, а во всех остальных странах дороговизна одного вклада компенсируется дешевизной другого и стоимость оказывается в среднем 450 евро. Правда, в некоторых странах — членах ЕС из-за очень высокой цены энергии есть предприятия, где стоимость цинка превышает 700 евро. Конечно, надо учесть, что все эти расчеты («Resources Policy») сделаны экономистами из Объединенного исследовательского центра Еврокомиссии по данным 2012—2013 годов, то есть до того, как из-за девальвации рубля курс евро поднялся в полтора раза. Тем не менее в этом цинковом расчете, как в капле воды, отразилось то, что называют низкой конкурентоспособностью российской промышленности на мировом рынке. А причины ее — низкая производительность устаревшего оборудования и высокие расходы, скрытые за таинственным словом «прочие».
