Работа над ошибками
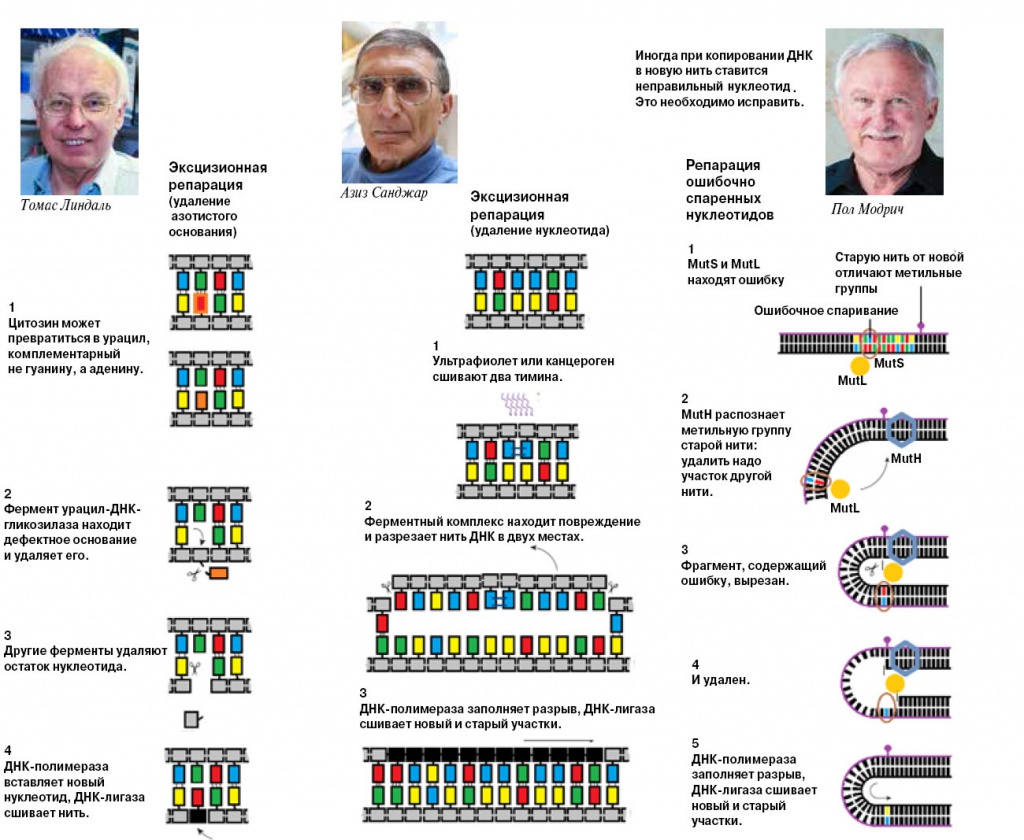
Нобелевская премия по химии 2015 года присуждена Томасу Линдалю (Швеция, Великобритания), Полу Модричу (США) и Азизу Санджару (Турция, США) за открытие механизмов репарации ДНК.
Мутация — резкое изменение признаков организма, наследуемое потомками, говорили век назад. Мутация — необратимое изменение в нуклеотидной последовательности генома, говорим мы сейчас. И даже совсем далекие от биологии люди знают, что мутация — это «опечатка в ДНК» (или в РНК, если геном РНКовый, как у некоторых вирусов).
К изменению фенотипических признаков ведет не всякое изменение генотипа. Бывают нейтральные мутации, бывают слабовредные — такая мутация изменяет, скажем, аминокислотную последовательность белка, но белок не перестает выполнять свою функцию, просто он выполняет ее чуть хуже. Таких мутаций больше, чем думают непосвященные. Как отметил А.С.Кондрашов, известный специалист по эволюционной биологии, в генотипе каждого человека присутствует от 900—1100 заменяющих аминокислоту слабовредных мутаций (http://postnauka.ru/faq/27820). Так что, со всем уважением, и читатели «Химии и жизни». и, конечно, авторы, — все мы мутанты. Но мутаций в нашем геноме было бы еще больше, если бы не механизмы, которые начали изучать в 70—80-е годы ХХ века лауреаты Нобелевской премии по химии 2015 года. Точнее, без этих механизмов мы просто не выжили бы.
Опечатки в ДНК, как и в обычном тексте, бывают разные. Большие или маленькие отрывки пропадают или повторяются несколько раз, перескакивают в другое место, совершенно неподходящее. Роль клавиш Shift-Del, Ctrl-C и Ctrl-V могут играть, например, мобильные элементы генома. Фрагмент текста может перевернуться задом наперед (а вот такого, пожалуй, с типографским текстом не случается). Однако нас сейчас интересуют однобуквенные опечатки. Они возникают, когда нуклеотид в старой нити поврежден так, что при репликации распознается с ошибкой. Или когда со старой нитью все в порядке, но фермент ДНК-полимераза, строя новую нить, случайно допускает описку, ставя вместо комплементарного нуклеотида другой. Фермент настолько умен, что может сам сделать поправку, откусив последний нуклеотид и вставив правильный. И все же ДНК-полимераза, как принято считать, сажает около пяти ошибок на каждые 10 тысяч букв. Это очень много, если помнить, что одна копия генома человека — 3 миллиарда пар нуклеотидных оснований, а копирование ДНК происходит при каждом клеточном делении.
|
|
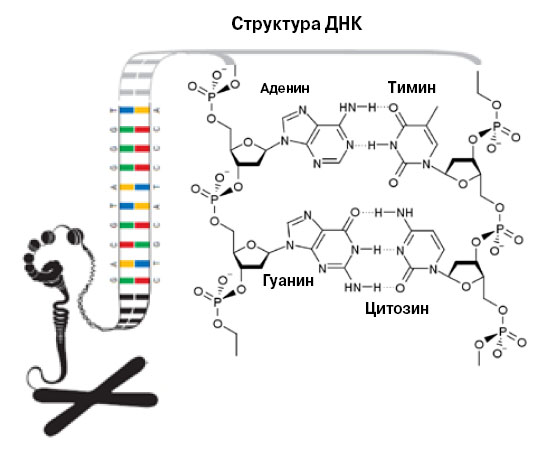
Спираль ДНК состоит из двух нитей, нити — из нуклеотидов, нуклеотиды содержат азотистые основания. Аденин всегда образует пару с тимином, гуанин — с цитозином. Согласно этому правилу происходит репликация (копирование) ДНК. Однако иногда правило нарушается, и в новых нитях возникают ошибки. Кроме того, «буквы» ДНК могут быть повреждены ультрафиолетом, канцерогенами, свободными радикалами... Повреждениям противостоит репарация ДНК |
Так что же, ДНК — ненадежное хранилище наследственной информации? Это не совсем так: она, во всяком случае, надежнее РНК, которая играла эту роль на начальных этапах эволюции и которая гораздо менее стабильна. (Подробнее о РНК-мире см. статьи М.А.Никитина в рубрике «Биогенез», «Химия и жизнь», 2013.) Правда, существует гипотеза, согласно которой древние вирусы «внедрили» ДНК вместо РНК не только и не столько ради ее стабильности, сколько для того, чтобы спастись от защитных систем хозяина—древней протоклетки: перешли, так сказать, на альтернативную кодировку. К тому же при небольшом размере генома и до изобретения многоклеточности ошибки репликации не представляли серьезной проблемы и даже приносили пользу: пусть погибнет клетка или вирус с неудачной мутацией, другие выживут. Нестабильность генома была источником изменчивости, а изменчивость — тот материал, с которым работает естественный отбор.
Не так обстоит дело у многоклеточных организмов: мутации в отдельно взятой клетке — причина рака и старения. Большое число ошибок для многоклеточного организма оказалось бы несовместимым с жизнью. Источником же изменчивости может быть половой процесс, а также другие способы перемешивания генов (о горизонтальном переносе генов и той роли, которую он, согласно современным представлениям, играет в эволюции, см. «Химию и жизнь, 2015, № 9, 10). Даже бактериям, как выяснилось, нужны специальные механизмы, снижающие число ошибок в ДНК. За открытие таких механизмов — систем ДНК-репарации — и были присуждены Нобелевские премии по химии этого года.
«Урацил — не найдено. Заменить на цитозин?»
Мы расскажем о трех таких системах. Они называются «эксцизионная репарация азотистого основания» (base excision repair, BER), «эксцизионная репарация нуклеотидов» (nucleotide excision repair, NER), и «репарация ошибочно спаренных нуклеотидов» (mismatch repair).
Заметим, что все трое лауреатов работали 60—80-е годы ХХ века, методами тогдашней молекулярной биологии. Рассказывать сегодняшним студентам, как они получали свои результаты, — не совсем то же самое, что объяснять юноше с GPS в смартфоне про секстант и астролябию, но что-то общее есть. Отсутствие современных способов исследования ДНК и белков они компенсировали изяществом и остроумием экспериментов.
Томас Линдаль работал в Каролинском институте (Стокгольм), что не без удовольствия отмечают представители Нобелевского комитета: в этот раз они награждают земляка. В конце 60-х Линдаль решил проверить, насколько нестабильна ДНК в физиологических условиях. Именно в физиологических, без воздействия канцерогенов и ультрафиолета. Результат был несколько пугающим: в геноме одной клетки человека в течение дня могли бы возникнуть тысячи мутаций. Например, азотистое основание цитозин может потерять аминогруппу. Получится урацил (U) — в ДНК такой буквы нет, но она есть в РНК. Там она заменяет тимин, а комплементарен урацилу, соответственно, аденин, а не гуанин, как исходному цитозину. В новой цепи, построенной на такой испорченной матрице, возникнет ошибка.
Понятно, что наша ДНК не деградирует с такой скоростью. Но если что-то не может не портиться и все же остается исправным, значит, кто-то его чинит.
Линдаль в начале 70-х открыл у кишечной палочки самый первый фермент репарации — урацил-ДНК-гликозилазу. Этот фермент выкусывает из цепи ДНК неуместный в ней урацил, отрывая его от дезоксирибозы. (Кстати, excision и означает «удаление, вырезание».) Затем другие ферменты удаляют остатки нуклеотида, и после этого ДНК-полимераза может вставить правильный — цитозин, комплементарный гуанину в другой цепи. Линдаль же установил, что этот фермент специфичен к ДНК, а на РНК не обращает внимания, — и хорошо, что так, иначе он попортил бы всю РНК, удаляя из нее урацилы.
У млекопитающих есть аналогичные ферменты — целый набор ДНК-гликозилаз, вырезающих из ДНК азотистые основания, по-разному испорченные. Ювелирное, буквально точечное исправление.
Править или переписывать?
Другой вид репарации, при котором удаляется и заменяется новым небольшой фрагмент нити ДНК, открыл Азиз Санджар. Турецкий лауреат (второй за всю историю Нобелевской премии; первым был писатель Орхан Памук) родился седьмым из восьми детей в небогатой семье. Его родители были не слишком образованными людьми, но считали очень важным, чтобы их дети получили образование. В 1963 году Санджар окончил медицинскую школу в Стамбуле, несколько лет работал врачом в турецкой глубинке, но в 1973 году решил заняться экспериментальной наукой — биохимией. (Оцените отвагу!) В ответ на вопрос, почему он решил поехать в Америку, Санджар привел слова Джона Леннона: дескать, если бы вы жили в Римской империи, вы хотели бы отправиться в Рим, потому что все самое важное происходит там.
В лаборатории Стенли Руперта (Техасский университет, Даллас), где Санджар делал диссертацию, исследовали удивительное явление: фотореактивацию бактерий. Ультрафиолетовое излучение подавляет их рост, а подсветка обычным светом возвращает к норме. Было известно, что от ультрафиолета страдает ДНК бактерий. Ультрафиолет ковалентно сшивает находящиеся рядом тимины (Т-Т), и это мешает синтезу ДНК. Резонно было предположить, что за исправление этой ошибки отвечает какой-то фермент. Санджар клонировал ген этого фермента кишечной палочки и исследовал его. Фермент назвали фотолиазой. Как выяснилось позднее, он использует фотоны света как источник энергии, чтобы разорвать тиминовый димер.
Защитив диссертацию, Санджар продолжил изучение репарации в Йельском университете. Там он занимался не фотолиазой (к которой вернулся позже), а так называемой темновой репарацией — восстановлением бактерий после УФ-облучения в отсутствие подсветки. Ранее было показано, что бактерия при этом вырезает участок ДНК с тиминовым димером — этот димер перемещается из фракции ДНК с большим молекулярным весом во фракцию с малым весом. Кроме того, были известны гены, мутации в которых делают бактерий гиперчувствительными к ультрафиолету; они получили названия uvrA, uvrB и uvrC. Были также указания на то, что именно их продукты расщепляют облученную ДНК.
В конце 80-х Санджар получил продукты этих генов (по тем временам это была очень нетривиальная задача) и смог реконструировать весь процесс репарации. Оказалось, что комплекс белков UvrA, UvrB and UvrC (этот комплекс назвали красивым словом «эксцинуклеаза») вырезает фрагмент поврежденной нити. Затем ДНК-хеликаза — фермент, раскручивающий двойную спираль и разделяющий нити — удаляет вырезанный фрагмент, а ДНК-полимераза заполняет прореху.
У человека подобная система репарации тоже есть, только участвуют в ней не три белка, а более пятнадцати. Мутации в генах этих белков вызывают наследственные заболевания, такие как пигментная ксеродерма, для которой характерны высокая чувствительность к ультрафиолету и предрасположенность к раку кожи. Кстати, именно у пациентов с этим заболеваниям были впервые идентифицированы многие гены человеческой системы NER.
Mismatch repair: исправленному верить
Хорошо, у нас есть механизмы, распознающие поврежденные нуклеотиды. Но что делать, если ДНК-полимераза, выстраивая новую нить, поставила не тот нуклеотид, какой надо? Как узнать, в которой нити ошибка? Сам нуклеотид нормальный, без повреждений, только не образует уотсон-криковской пары с нуклеотидом другой нити. Продолжая аналогию с текстами — представьте, что в одном варианте стоит «человеку свойственно ошибаться», в другом «счеловеку свойственно ошиваться», и поди пойми, то ли автор серьезно цитировал латинскую пословицу, а потом случилась ошибка при наборе, то ли автор шутил, а ему попался слишком серьезный корректор...
Опытный издательский работник сразу же ответит: надо найти исходный вариант и править по нему. Как установил третий лауреат, Пол Модрич (Университет Дюка), клетка может это сделать: отличить материнскую нить от дочерней — матрицу от копии — и выправить вторую по первой. Важную роль в этом играет метилирование ДНК. Метилирование еще не так знаменито, как мутации, и все-таки о нем наслышаны многие. Например, обратимое присоединение метильных групп к ДНК лежит в основе эпигенетического наследования — оно регулирует активность генов, а, следовательно, и признаки организма, не затрагивая последовательности ДНК. С метилированием связаны и рак, и старение, и воздействие на организм меняющихся условий (так, на узор метилирования у человека воздействуют интенсивные физические упражнения). Метилирование у бактерий во многих отношениях отличается от метилирования у высших организмов, но оно у них тоже есть и тоже важно.
Модрич заинтересовался ферментом метилазой Dam кишечной палочки еще в конце 1970-х. У кишечной палочки метилированы обе нити ДНК, но пришивание CH3-групп к ДНК требует времени, так что в дочерней цепи их, естественно, меньше, чем в материнской. Метью Мезелсон из Гарвардского университета в 1976 году предположил, что именно по метильным группам бактерия определяет, какая из цепей старая. В совместных экспериментах Мезелсон и Модрич подтвердили это напрямую. Метилирование ДНК подсказывало клетке, какую из цепей корректировать, с другой стороны, потеря функции метилазы повышала уровень мутаций.
К концу 80-х годов Модричу удалось реконструировать весь процесс in vitro. Белок MutS находит «мисмэтч» (mismatch) — некомплементарную пару нуклеотидов в ДНК, MutH связывается с «полуметилированным» сайтом GATC — легко видеть, что эта последовательность одинакова в обеих нитях, но в материнской будет метильная группа, а на дочерней нет. MutL связывает два эти белка, и после этого MutH разрезает дочернюю нить. Затем опять-таки ДНК-хеликаза помогает удалить фрагмент и ДНК- полимераза синтезирует новый, правильный.
Это все мы рассказывали про бактерию. Уже в XXI веке Модрич с соавторами реконструировал эукариотическую систему с той же функцией. Правда, в геноме человека с метилированием все несколько по-другому, и что у нас направляет репарацию ошибочно спаренных нуклеотидов — еще предстоит выяснить; идеи есть, но они нуждаются в доказательствах. Так или иначе, именно этот механизм уменьшает количество ошибок, оставленных ДНК-полимеразой, с единиц на десятки тысяч нуклеотидов до единиц на сотни миллионов.
Но как быть с ошибками, которые все же ускользают от контроля систем репарации и накапливаются? Некоторых философов беспокоит, что мы, люди, ослабили давление естественного отбора на наш вид. С одной стороны, конечно, прекрасно, что Homo sapiens с незначительно пониженной приспособленностью больше не умирают бездетными, — неумение быстро бегать, возможно, сопровождается у них какими-то ценными качествами, например, математической одаренностью. С другой стороны — как далеко может зайти снижение приспособленности?
Понятно, что мы не можем свернуть с пути, на который ступили еще наши далекие предки, когда начали заботиться о своих больных. Против этого восстанет вся наша этика, которая сама имеет огромную приспособительную ценность. Очевидно, нам следует пройти этот путь до конца, а именно научиться корректировать ошибки в геноме, избегая их опасного накопления — и в личной жизни отдельной особи, и в истории вида.
Идеальный репаративный комплекс как лекарство от старения и рака — пока полная фантастика. Но есть противораковые лекарства, использующие наши знания о репарации и действующие в противоположном направлении, по принципу «падающего толкни». Коль скоро в раковой клетке повреждены механизмы репарации, повредим их еще сильнее, и клетка умрет. Именно так работает, например, олапариб — сравнительно новое лекарство. Несомненно, будут появляться и другие. Фундаментальное знание о том, как хранится и восстанавливается наша наследственное информация, никогда не утратит практической ценности.
