Подписаться
Подписаться
Веселящий газ
В химию я пришел через олимпиады. И уже в седьмом классе (у нас было десятилетнее образование) мы чертили структурно-валентные формулы разных простеньких веществ. Именно тогда, готовясь к олимпиадам, я с удивлением узнал, что в оксиде азота (I), знаменитом веселящем газе, о существовании которого я вообще узнал из песни Гребенщикова (помните — «из кухонных кранов бьет веселящий газ...»), в общем, там — азот не одновалентный, как нас учили в школе. Еще и волшебные слова «резонансная структура» появились в лексиконе у нас, восьмиклассников, что помогло нам впоследствии справиться с ароматическими соединениями.
Что же, давайте разберемся с этим интереснейшим соединением, которое совсем не так просто, как кажется из его брутто-формулы N2О.
Впервые человечество познакомил с ним британский химик (впрочем, тогда было принято говорить «натурфилософ»), первооткрыватель кислорода Джозеф Пристли. В своей книге «Эксперименты и наблюдения за разными видами воздуха», вышедшей в 1775 году, он рассказал, как тремя годами ранее получил «флогистинированный нитрозный воздух» нагреванием железных опилок, смоченных азотной кислотой. Кстати, тогда же он открыл и монооксид азота NO. Его Пристли назвал «селитряным воздухом». (На рисунке — приборы Пристли.) Впрочем, сейчас не о «старшем брате» нашего героя.
Названий у N2O— множество. Закись азота, оксид азота (I), веселящий газ, оксонитрид азота (I), оксид диазота… «Химия ваша обильна и богата, а порядку в ней нет». Что же представляло собой открытие Пристли? Газ, бесцветный, негорючий, сладковатый приятный запах и даже привкус. Очень небольшая разница между температурами кипения и замерзания — при -88°С он еще веселящий газ, а при -91°С это уже веселящий снег. Чуть больше двух градусов Кельвина интервал существования жидкой фазы!
Практического применения нашему герою пришлось ожидать чуть более двух десятков лет. В 1794 году вышла книга одного из изобретателей паровой машины Джеймса Уатта и реформатора медицины Томаса Беддоу «Соображения о медицинском использовании и производстве искусственных воздухов» (именно так, тогда воздухов было много — как мы помним, Пристли называл воздухами оксиды азота). В этой книге было два важных момента. Во-первых, Уатт предложил «машину» для производства N2O, а также ингаляционный прибор для медицинского использования газов. А во-вторых, Беддоу представил новую теорию о том, что туберкулез и другие легочные заболевания могут быть излечены ингаляциями «искусственных воздухов». Не сработало, конечно, зато способ употребления был найден.
Прошло еще полвека, и Гораций Уэллс, американский стоматолог, провел первое в истории удаление зуба с анестезией веселящим газом. Впрочем, наркотические качества веселящего газа стали известны еще в XVIII веке. С 1799 года и минимум до 1863-го источники отмечают новую забаву среди высшего света в Великобритании — «вечеринки веселящего газа», где салонная публика собиралась, чтобы надышаться закисью азота до явления короля Артура. Эта мода в последние десятилетия возобновилась, среди английской молодежи в том числе.
Интересно, что наркотический и обезболивающий эффекты оксида азота, по-видимому, обеспечиваются двумя разными механизмами. Хотя он считается безопасным для здоровья, злоупотреблять им все же не стоит. Он окисляет витамин В12 и тем самым создает его дефицит в организме, поэтому пристрастие к N2О-вечеринкам может вызвать серьезные изменения в нервной системе. Опасен он и для сердечников. А самое последнее дело — вдыхать N2O немедицинского и непищевого назначения, в котором могут быть опасные примеси. Кстати, пищевое применение N2O— это, например, вспенивание взбитых сливок и заполнение вакуум-упаковок со всякими вкусными вещами. Лучше уж таким способом получать от него удовольствие.
Любителям автотюнинга наш герой тоже добавляет веселья. А точнее — бодрости двигателю их автомобиля. Впрыск N2O в цилиндры снижает температуру всасываемого в цилиндры воздуха, увеличивая плотность смеси, и повышает скорость сгорания топлива. Кстати, любопытно, что и это применение оксида азота не ново, первым в двигателях его использовал еще пионер ракетного дела Роберт Годдард, ив прошлом году исполнился ровно век со дня начала зажигательной карьеры веселящего газа.
Но вернемся в завершение нашей статьи к олимпиаде и структурным формулам. Так как же выглядит на самом деле молекула оксида азота? Неужели кажущаяся логичной структурная формула N-O-N — неправильна?
Совершенно верно. Молекула N2O cовсем не такая, и дело не в кратности связей. Даже топологически она устроена иначе — два атома азота соединены друг с другом, и к одному из них присоединен атом кислорода.
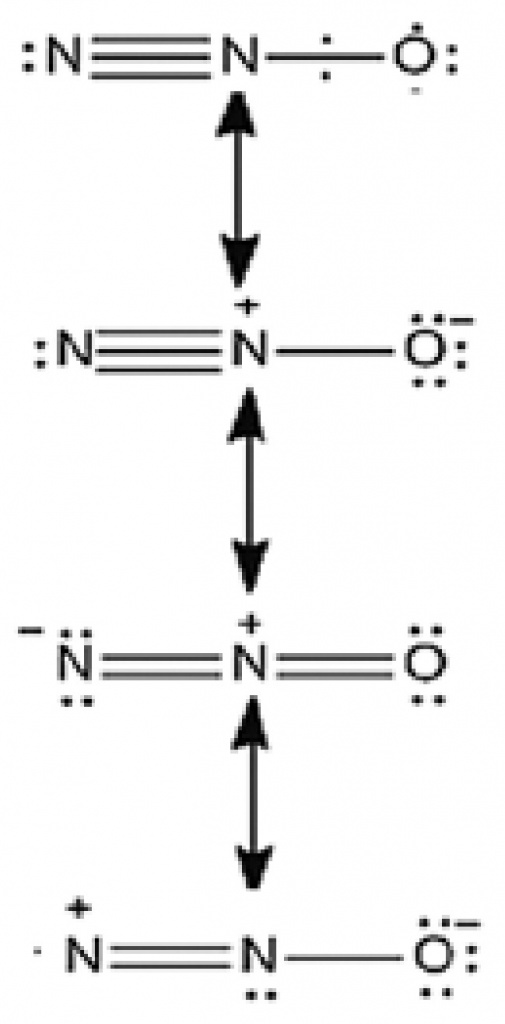
Более того, одной структурной формулой тут не обойтись. Есть целых четыре структуры, которые описывают эту молекулу, и каждая вносит в ее настоящий вид свой вклад (см. рис.). Здесь нет одинарных, двойных и тройных связей, если выражаться точно, то связь азот-азот имеет кратность 2,73, а связь азот-кислород — 1,61.
Остается только удивляться, сколько сложностей, тонкостей и неожиданностей может прятаться всего в трех атомах — или трех символах знакомой со школы формулы N2O.