Вдали от равновесия

 В нашем сознании существовал и существует разрыв, разделяющий скучный мир, который изучают в лабораториях, и неисчерпаемое богатство проявлений реальной жизни. По-видимому, наиболее значительный вклад в строительство моста, соединяющего эти два мира, внес выдающийся бельгийский физик-теоретик русского происхождения Илья Романович Пригожин (1917—2003).
В нашем сознании существовал и существует разрыв, разделяющий скучный мир, который изучают в лабораториях, и неисчерпаемое богатство проявлений реальной жизни. По-видимому, наиболее значительный вклад в строительство моста, соединяющего эти два мира, внес выдающийся бельгийский физик-теоретик русского происхождения Илья Романович Пригожин (1917—2003).
Первое начало
Пригожин родился в Москве 25 января 1917 года в семье предпринимателя (химика по образованию) и пианистки. В 1921 году семья Пригожиных эмигрировала из России и после нескольких лет странствий в 1929 году поселилась в Бельгии.
В юности Илья Пригожин мечтал стать музыкантом. Эта мечта не осуществилась. Но, посвятив жизнь науке, Пригожин сохранил свой артистизм. Недаром его часто называли «поэтом термодинамики».
Научная деятельность И.Р.Пригожина началась в 1940-х годах. В центре его внимания всю жизнь находились проблемы термодинамики — раздела физики, который изучает системы, состоящие из огромного количества частиц, и пытается понять, что возможно, а что невозможно в таких системах.
Классическая термодинамика была создана в середине XIX века. Ее основой стал закон сохранения энергии, который впервые сформулировал немецкий врач Юлиус Роберт Майер (1814—1878) и, в более четкой форме, Джеймс Джоуль (1818—1889) и Герман Гельмгольц (1821—1894). Современный вид ему придал в начале 1850-х годов великий английский физик-теоретик Уильям Томсон, барон Кельвин (1824—1907).
Прежде всего именно Кельвин ввел в научный обиход слово «энергия». Это слово использовал в древности Аристотель, затем оно было надолго забыто. Исследователи XVII и XVIII веков употребляли другие термины, например «живая сила». В 1807 году Томас Юнг (1773—1829) попытался реанимировать термин «энергия», но без особого успеха. Под энергией Юнг понимал способность движущегося тела совершить механическую работу — переместить другое тело и при этом преодолеть силу, сопротивляющуюся перемещению. Этот вид энергии мы сегодня называем механической.
Кельвин создал современное понятие об энергии как о фундаментальной физической величине, а также о разных формах энергии (механической, тепловой, электрической и т. д.) ио способности энергии переходить из одной формы в другую. Вскоре шотландский физик и инженер Уильям Ренкин (1820—1872) ввел понятие потенциальной энергии, то есть энергии, в настоящий момент не проявляющей себя, но способной проявиться в определенных условиях. Он же начал использовать понятие внутренней энергии и проанализировал взаимосвязь между изменением внутренней энергией системы, выделением тепла и совершаемой системой работой.
В 1850-х годах было сформулировано первое начало термодинамики. Согласно ему, сумма выделившегося тепла и работы, совершенной системой при переходе из одного состояния в другое, не зависит от пути, по которому этот переход происходил. Иными словами, внутренняя энергия — это функция состояния системы. По существу, первое начало термодинамики представляло собой тот же закон сохранения энергии, но в несколько иной формулировке.
Рождение классической термодинамики
Первое начало термодинамики в принципе не исключало возможности совершения работы за счет самопроизвольного охлаждения тела до температуры более низкой, чем у окружающей среды. Но такого никогда не наблюдалось. Поэтому встал вопрос о введении в термодинамику дополнительных ограничений.
Первый шаг по формулировке таких ограничений сделал еще в 1824 году французский физик и инженер Никола Сади Карно (1796—1832). Он проанализировал работу тепловых машин и пришел к выводу, что она возможна лишь при наличии «нагревателя» и «холодильника», притом предельный КПД тепловой машины зависит не от того, какое рабочее тело в ней используется, а исключительно от разности температур между нагревателем и холодильником. Перед смертью Сади Карно сжег черновики своих трудов. Сохранилась лишь записная книжка, в которой содержалась идея второго начала термодинамики.
В 1850 году немецкий физик Рудольф Клаузиус (1822-1888) реанимировал труды Карно и придал его утверждениям ранг фундаментального закона физики. В 1865 году он вводит еще одну функцию состояния системы — энтропию.
Предположим, что исследуемая система состоит из двух частей, имеющих разную температуру. Тогда некоторое количество тепла Q перейдет от более нагретого тела к менее нагретому. При этом энтропия более нагретой части уменьшится на величину Q/T1, а энтропия менее нагретой — увеличится на Q/T2 (где T1 и T2 — абсолютные температуры более и менее нагретой частей). Ясно, что суммарная энтропия системы возрастет.
Клаузиус сформулировал положение о том, что в замкнутой системе, не обменивающейся ни веществом, ни энергией с окружающей средой, энтропия не может убывать. Вдали от равновесия она будет возрастать, а в состоянии равновесия достигнет максимально возможного значения и далее меняться не будет. Это утверждение стало называться вторым началом термодинамики.
Из второго начала термодинамики вытекало важное понятие термодинамического равновесия. И это открыло пути для широкого внедрения термодинамики в химию.
В 1864 году норвежцы Като Гульдберг и Петер Вааге сформулировали закон действующих масс, из которого следовал вывод о том, что любая химическая реакция является обратимой и что рано или поздно должно установиться равновесие между исходными реагентами и продуктами реакций. Термодинамика смогла предложить ответ на вопрос: чем определяется соотношение исходных реагентов и продуктов реакции при равновесии?
Пробирка, в которой протекает химическая реакция, не является замкнутой системой, поскольку обменивается теплом с окружающей средой. Если реакция идет с выделением тепла, то пробирка отдает тепло в окружающую среду, если с поглощением тепла — соответственно забирает его. Поэтому при движении к равновесию энтропия внутри пробирки может и убывать. Чтобы охарактеризовать равновесие, нужно отслеживать изменение другой функции состояния. В 1870-х годах Джозайя Уиллард Гиббс (1839—1903) и Герман Гельмгольц предложили на эту роль свободную энергию, которая в равновесной системе принимает минимальное значение.
Гиббс и Гельмгольц ввели свободную энергию несколько по-разному. Гельмгольц рассматривал ее как величину, равную U–T⋅S (U — внутренняя энергия, T —температура, отсчитываемая от абсолютного нуля, S — энтропия), Гиббс же добавил к ней величину pV (p — давление, V — объем). Минимум свободной энергии Гельмгольца соответствовал равновесию при постоянном объеме и температуре, минимум свободной энергии Гиббса — при постоянных давлении и температуре. На практике лучше пользоваться свободной энергией Гиббса, поскольку реакционная смесь может расширяться, а давление определяется неизменным давлением воздуха.
Гиббс ввел очень важные понятия химического потенциала вещества, отражающее заключенный в нем запас свободной энергии, и разности химических потенциалов между исходными реагентами и продуктами реакции. В состоянии химического равновесия разность потенциалов обращается в нуль.
За работами Гиббса и Гельмгольца стояла такая мысль: один грамм-моль разных веществ может содержать не одинаковые запасы энтропии, иными словами, энтропия связана не только с теплом, но и со строением веществ. Эта мысль развивал в 1870-х годах и австрийский физик Людвиг Больцман (1844—1906), опиравшийся на идею об энтропии как мере хаотичности в распределении вещества. Больцман первым сформулировал мысль о том, что за вторым началом термодинамики стоят статистические закономерности, с большой точностью работающие в системах из огромного числа частиц.
Классическая термодинамика Томсона — Клаузиуса — Гиббса — Гельмгольца — Больцмана, по существу, занималась только проблемой термодинамического равновесия. Она утверждала лишь то, что система в состоянии равновесия, определяемом минимумом или максимум каких-то функций состояния, сама из этого состояния не выйдет. Некоторые физики даже критиковали сам термин «термодинамика», ибо никакой динамики в ней нет, одна только статика.
О том, как будет вести себя система, не находящаяся в состоянии равновесия, классическая термодинамика ничего сказать не могла. Поиском ответа на этот вопрос занялась термодинамика неравновесных систем, одним из создателем которой стал Илья Романович Пригожин.
Рядом с равновесием
Первым шагом на пути создания неклассической термодинамики стало исследование процессов в неравновесных системах вблизи от состояния равновесия. Важные шаги в этом направлении сделал работавший в США норвежский физик-теоретик Ларс Онзагер (1903—1976). Методами статистической физики он вывел простые, но очень важные количественные соотношения между скоростями разных процессов и разностями потенциалов в неравновесных системах вблизи термодинамического равновесия. За эту работу Онзагеру в 1968 году была присуждена Нобелевская премия. Правда, почему-то не по физике, а по химии.
На основании работ Онзагера И.Р.Пригожин сформулировал в 1947 году знаменитую теорему, носящую его имя. Она легла в основу термодинамики неравновесных, но близких к равновесию систем.
Эта теорема утверждала, что если мы искусственным образом поддерживаем некоторые потенциалы постоянными, то скорость расходования свободной энергии можно рассматривать как функцию состояния системы (отношение этой величины к абсолютной температуре называют скоростью продуцирования энтропии). В этом случае система придет в неравновесное устойчивое состояние, которое будет характеризоваться минимумом скорости продуцирования энтропии внутри системы. Хотя, наверное, было бы правильнее говорить о минимуме скорости расходования свободной энергии за счет внутренних процессов.
В неравновесном устойчивом состоянии внутри системы свободная энергия расходуется, но общий ее запас остается постоянным, так как система получает свободную энергию извне за счет работы механизмов, поддерживающих постоянными некоторые потенциалы.
Таким образом, впервые методами термодинамики было сделано содержательное заключение о поведении системы в неравновесном состоянии, хотя и вблизи от термодинамического равновесия.
Но что будет происходить вдали от термодинамического равновесия, где зависимости между потоками и силами будут нелинейными? Уже в 1947 году Пригожин отмечал, что вдали от равновесия могут устанавливаться сложные динамические режимы и возникать пространственные структуры, структуры, способные к самопроизвольному усложнению. Из этого пророчества выросли представления о диссипативных структурах, а затем и новая область физики — синергетика.
 |
|
Ларс Онзагер |
Колебания и ячейки
Итак, в системах, далеких от равновесия, может наблюдаться сложная временна́я динамика. В частности, возможны колебания концентрации химических веществ в реакциях, протекающих в однородной среде. Пригожин предложил модель многоэтапной реакции с автокатализом, в которой наблюдались автоколебания промежуточных продуктов. Эта модель получила название «брюсселятор» (производное от Брюсселя, где работал Пригожин, и «осциллятора»).
Химическую реакцию с автоколебаниями концентраций промежуточных продуктов экспериментально обнаружил в 1951 году русский военный химик Борис Павлович Белоусов (1893—1970). Выглядела эта реакция весьма эффектно: раствор менял цвет с периодом от долей секунды до десятков минут, а в тонком слое (в мелкой посуде) возникали волны разных цветов. Однако химическая общественность не поверила в существование колебательной реакции, и работы Белоусова неизменно отклонялись научными журналами, только в 1959 году он смог опубликовать небольшую заметку в ведомственном сборнике. И лишь после того, как реакцией Белоусова всерьез занялись на кафедре биофизики физического факультета МГУ, эффект получил признание. В 1980 году Б.П.Белоусову была посмертно присуждена Ленинская премия. В настоящее время известны и другие химические реакции с автоколебаниями, в частности реакция Бриггса — Раушера.
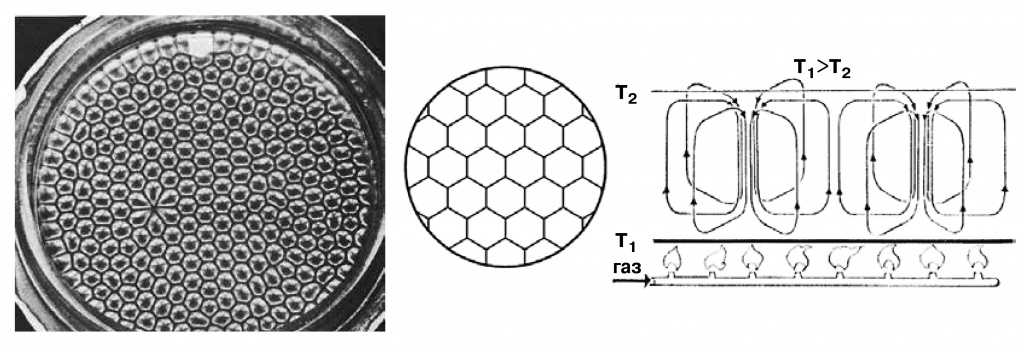
Наиболее известным в середине ХХ века примером сложных пространственных структур, образующихся вдали от равновесия, стали ячейки Бенара. Если покрыть сковородку слоем расплавленного парафина или какой-то другой вязкой жидкости, то при нагревании поверхность разделится на ячейки, в каждой из которых установятся потоки жидкости: в центре она будет подниматься, по краям опускаться. (Собственно, такие ячейки видны ив обыкновенном подсолнечном масле на сковородке.) Это явление обнаружил в 1901 году французский физик Анри Бенар (1874—1939). Нечто подобное ячейкам Бенара формируется, по-видимому, ив недрах Земли, именно с этими процессами связано движение континентов.
 |
|
Ячейки Бенара |
В 1952 году выдающийся английский математик Алан Тьюринг (1912—1954) использовал идеи И.Р.Пригожина для анализа процессов эмбрионального развития, разработав модель, позволяющую получать достаточно сложные пространственные структуры. Тьюринг внес выдающийся вклад в развитие многих разделов кибернетики и по праву считается одним из ее создателей. К сожалению, из-за уголовного преследования, которому этот талантливый математик подвергся по причине своей нетрадиционной сексуальной ориентации, Тьюринг покончил жизнь самоубийством.
Возможность появления сложных пространственных структур вытекала и из модели брюсселятора. А экспериментально они были обнаружены в системах, где шла реакция Белоусова. Большой вклад в теоретическое и экспериментальное изучение структур, образующихся в этой реакции, внесли отечественные исследователи Анатолий Маркович Жаботинский (1938—2008), Альберт Николаевич Заикин (р. 1934), Валентин Израилевич Кринский (р. 1938) и др. Активную поддержку этим исследованиям оказывали директор Института теоретической и экспериментальной биофизики РАН в Пущино-на-Оке Генрих Романович Иваницкий и заведующий лабораторией физической биохимии этого института Симон Элиевич Шноль.
Крыло бабочки
 |
|
Эдвард Лоренц |
В настоящее время известны два механизма «эффекта бабочки». Первый был известен еще до Лоренца: в системах существует несколько стабильных режимов, и если система находится на границе между ними, то малое случайное воздействие может перебросить ее из области притяжения одного режима в область притяжения другого. В таких случаях говорят, что система находится близ области раздела, или, по-научному, области бифуркации. Эта область находится вдали от термодинамического равновесия, подходы равновесной и линейной неравновесной термодинамики в ней не работают, потому будущее и непредсказуемо.
Есть основания считать, что в настоящее время человечество находится близ области бифуркации между двумя стабильными режимами. В одном из них человечество будет продолжать существовать, в другом — вымрет. Таким образом, наше будущее сильно зависит от наших сегодняшних действий. Об этом много говорилось в трудах выдающегося отечественного математика Никиты Николаевича Моисеева (1917—2000).
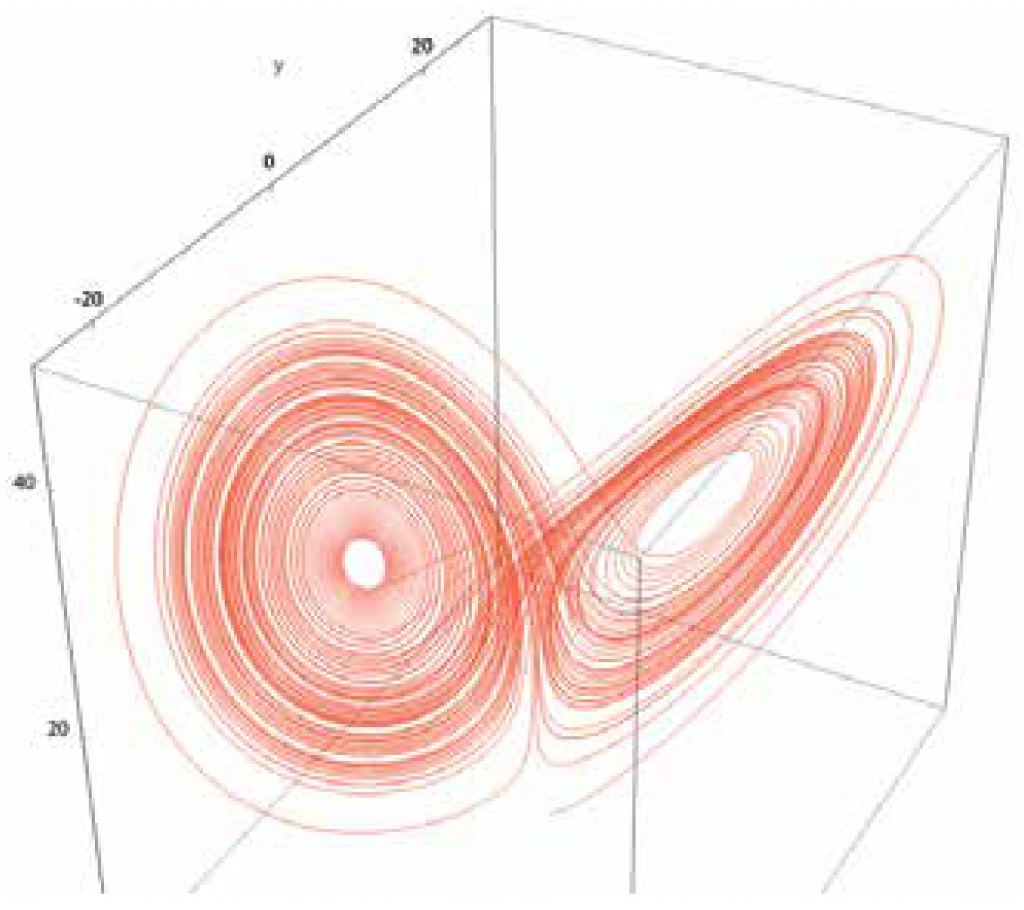
Эдвард Лоренц выявил второй механизм, обеспечивающий практическую непредсказуемость поведения сложной системы, далекой от равновесия. Он показал, что непредсказуемость может возникать не только вблизи границ раздела между стабильными режимами, но и в самих стабильных режимах.
Традиционно считалось, что все системы стремятся к устойчивому стабильному состоянию, где все остается неизменным. Но в дальнейшем были найдены и описаны системы, где происходят устойчивые колебания со стабильными периодом и амплитудой. С помощью математических моделей Лоренц открыл новый тип систем, в которых значения переменных, характеризующих их свойства, все время меняются, оставаясь, впрочем, в определенной области. Эти изменения описываются системой дифференциальных уравнений и поэтому, казалось бы, должны быть строго детерминированными. Тем не менее они имеют вид совершенно случайных блужданий.
Такие системы были названы системами со странными аттракторами. С одной стороны, странные аттракторы можно рассматривать как устойчивые режимы (значения переменных остаются в замкнутой области), ас другой — внутри этой области они меняются практически непредсказуемо, и малые случайные изменения переменных могут сильно изменить их значения в будущем.
 |
|
Траектория блуждания точки, описываемая системой дифференциальных уравнений, которую изучал сам Лоренц (dx = 10(y-x), dy= x(28-z)-y, dz = xy-8z/3). Точка описывает нечто вроде трехмерной восьмерки, но ее траектория непостоянна, она то делает круг за кругом, то переходит в другую петлю. Эта фигура напоминает расправленные крылья бабочки. |
Аристократ науки
В 1977 году И.Р.Пригожин был удостоен высшей научной награды — Нобелевской премии, хотя, как и Онзагер, почему-то по химии, а не по физике. В том же 1977 году немецкий физик Герман Хакен (р. 1927) предложил название «синергетика» для нового раздела физики, изучающего процессы самоорганизации в самых разных системах вдали от термодинамического равновесия.
Термодинамика необратимых процессов, теория диссипативных структур и тесно связанная с ней синергетика стали сегодня одним из теоретических фундаментов биологии и биологической физики.
Научные направления, заложенные И.Р.Пригожиным, интенсивно развиваются в России. Изучение сложных режимов, возникающих в сильно нелинейных системах, крайне интересовало отечественных физиков. Выдающийся вклад в их изучение внес, в частности, выдающийся советский физик и математик А.А.Андронов (1901—1952), который был прототипом академика Дронова в пьесе и кинофильме «Все остается людям». Интересно, что в юности А.А. Андронов мечтал стать врачом и внедрять в медицину физические идеи. Также стоит упомянуть в этой связи выдающегося физика-теоретика и биофизика Д.С.Чернавского (1926—2016).
В 1982 году Академия наук СССР избрала Илью Романовича Пригожина своим иностранным членом. В 1989 году король Бельгии даровал ему бельгийское дворянство и пожаловал титул виконта (выше барона, но ниже графа, по меркам Российском империи — «ваше высокоблагородие»).
И в самом деле, Илью Романовичу были свойственны привычки аристократа в лучшем смысле этого слова. Ибо аристократизм — это не происхождение, а образ жизни. Он никогда никуда не торопился (но все успевал), любил искусство, коллекционировал произведения живописи. Был прекрасным пианистом и даже сочинял музыку. Его музыкальные произведения неоднократно исполнялись по радио.
Мне представляется, что главное значение трудов И.Р.Пригожина и других исследователей, работавших и работающих в том же направлении, заключается в создании фундамента для будущего слияния разных научных дисциплин в единую Науку. В будущем мире человечество вернется к идеалу греческого мудреца, способного размышлять обо всем на свете. Но только уже на новом уровне.
