Происхождение белкового синтеза и генетического кода

Итак, в начале архейского периода Земля была покрыта плотной углекислотной атмосферой. Геотермальные источники выносили из глубин земной коры сульфиды цинка и марганца, на поверхности которых шли фотохимические реакции восстановления CO2, синтеза органики и полимеризации различных мономеров. Из этой системы под действием ультрафиолета отобрались длинные РНК-подобные молекулы, образующие двуспиральные участки за счет уотсон-криковских комплементарных пар. Они катализировали некоторые химические реакции, в том числе ведущие к синтезу нуклеотидов и полимеризации собственных копий. Так выглядел «мир РНК» накануне появления белков.
|
|
1. Синтез белка в клетках |
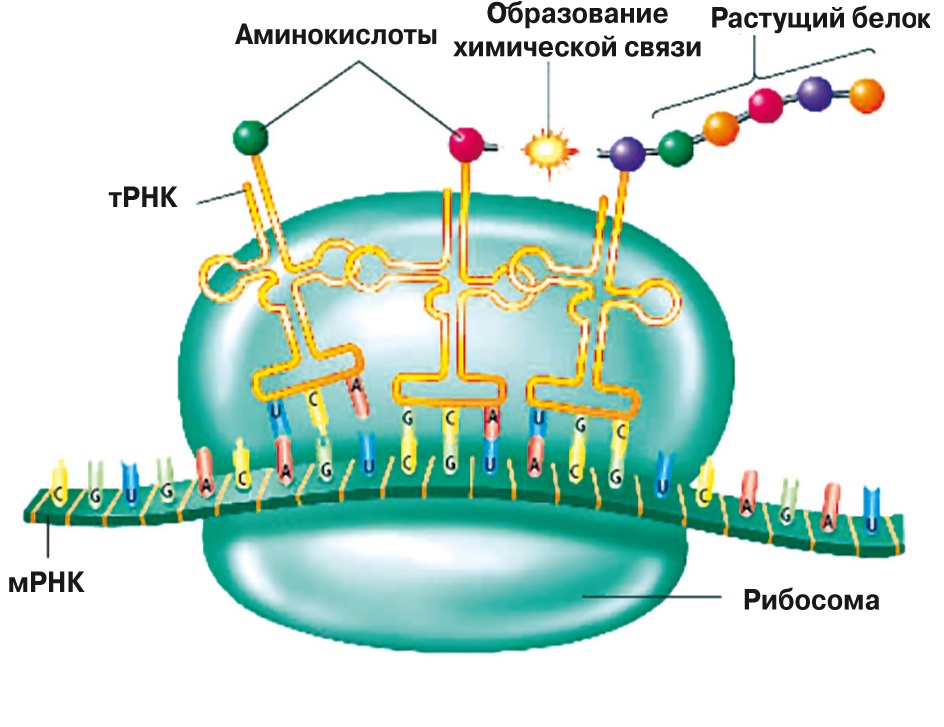
Система синтеза белка в современных клетках устроена достаточно сложно (рис. 1). Главная ее часть — рибосома, наномашина, которая соединяет аминокислоты в пептидные цепи по инструкции, закодированной в матричной РНК. Рибосома состоит из трех молекул РНК общей длиной до 5000 нуклеотидов и примерно 70 белков. Кроме того, для работы рибосомы нужна система подачи активированных аминокислот, которая включает в себя примерно 40 типов транспортных РНК, 20 типов ферментов — аминоацил-тРНК-синтетаз, и еще десяток вспомогательных белков — факторов инициации, элонгации и терминации.
Неизвестны более простые варианты этой системы, способные проводить синтез белка, хотя бы с меньшей точностью и скоростью. Поэтому сторонники «теории разумного замысла» (современной версии креационизма, утверждающей, что системы «определенной сложности» не могли возникнуть без вмешательства Творца) считают белковый синтез одним из примеров системы, адаптивной только в полном виде, а ее развитие шаг за шагом — невозможным. Но ученые нашли следы постепенного происхождения компонентов этой сложной системы.
Сначала нам придется сделать небольшое отступление. Одним из следов мира РНК считаются нуклеотиды, встречающиеся в тех местах, где без них прекрасно можно обойтись, например, в составе коферментов. (Коферменты — малые молекулы, расширяющие возможности катализа химических реакций в живых системах. В предыдущей статье мы рассказывали про кофермент А, переносящий углеводородные фрагменты в фундаментальных реакциях метаболизма.)
|
|
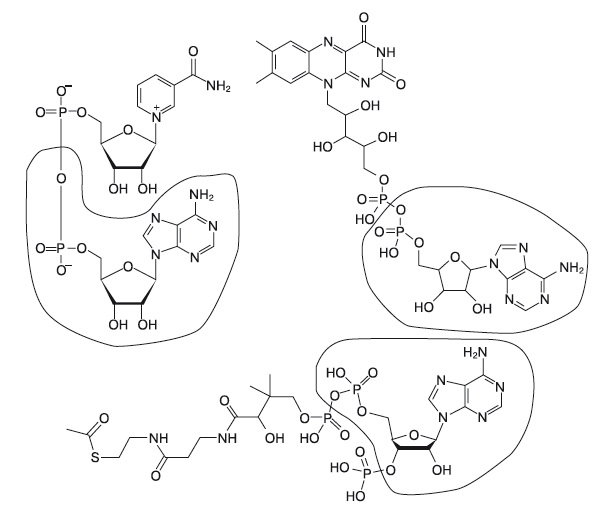
2. Строение коферментов NAD (слева вверху), FAD (справа вверху) и кофермента А (внизу) |
Многие важнейшие коферменты содержат адениновый нуклеотид: у кофермента А к нему присоединена молекула витамина В5, у NAD — витамин РР, у FAD — витамин B2. Адениновый нуклеотид также входит в состав витамина В12 (рис. 2).
Аденин в составе коферментов никак не участвует в их работе и служит только для узнавания коферментов белками. Скорее всего, это наследие РНК-мира, в котором витамины были пришиты к специальным молекулам РНК для расширения их каталитических возможностей.
Аминокислоты химически более разнообразны, чем нуклеотиды, и до появления белков они могли участвовать в функционировании РНК-мира в том же статусе, что и витамины: как вспомогательные группы, пришитые к молекулам РНК. Таким образом, рибозимы с функцией аминоацил-тРНК-синтетаз, то есть способные прикреплять аминокислоты к предшественникам транспортных РНК, могли быть востребованы задолго до появления белкового синтеза. Такие рибозимы получены в экспериментах по искусственному отбору каталитических РНК, и по скорости и точности работы они не уступают белковым аминоацил-тРНК-синтетазам.
Современные белковые аминоацил-тРНК-синтетазы распадаются на два неродственных класса, которые сильно отличаются по трехмерной структуре и узнают тРНК с разных сторон. Построение филогенетических деревьев по аминокислотным последовательностям показывает, что к моменту появления современных аминоацил-тРНК-синтаз уже существовало большое разнообразие белков — более сотни видов. А это подтверждает тот факт, что рибозимы с аминоацил-тРНК- синтетазной активностью должны были участвовать в синтезе белков в древности и белки их сменили довольно поздно. Этот аргумент рассматривают в своей статье Юрий Вольф и Евгений Кунин («Biology Direct», 2007, 2, doi: 10.1186/1745-6150-2-14).
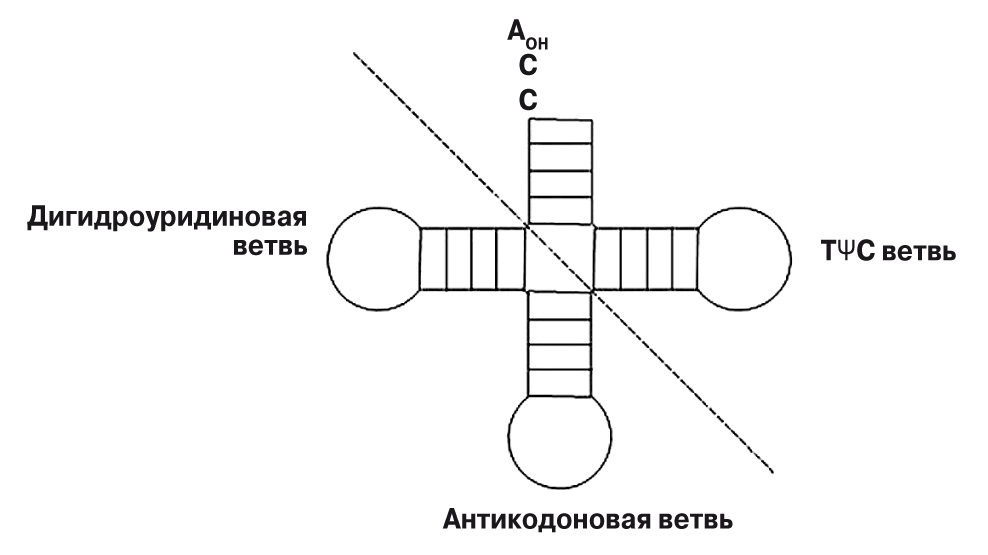
Транспортные РНК (тРНК) — скорее всего, еще более древняя деталь системы синтеза белка. Все эти небольшие (76 нуклеотидов длиной) молекулы имеют одинаковую пространственную укладку с четырьмя двухспиральными участками, которая на плоскости изображается в виде клеверного листа (рис. 3). На «черешке» у всех тРНК есть свободный фрагмент ССА (цитозин-цитозин-аденин), к которому прикрепляется аминокислотный остаток.
|
|
3. Транспортная РНК имеет ряд характерный признаков (здесь перечислены не все). К ССА-концу фермент аминоацил-тРНК-синтетаза прикрепляет аминокислотный остаток, который тРНК и доставляет к рибосоме (см. рис. 1). Средняя ветвь содержит антикодон — три нуклеотида, комплементарные кодону в матричной РНК (см. рис. 1). В дигидроуридиновой ветви часто присутствуют дигидроуридины — нуклеотиды, в которых к урацилу присоединены два водорода. Четвертая ветвь содержит последовательность ТΨС, где Ψ — еще один нуклеотид с модификацией урацила, псевдоуридин |
Но эти «клеверные листы» используются не только в синтезе белка. Как выяснилось, тРНК-подобные структуры участвуют в репликации РНК-вирусов и ретровирусов. Такая структура есть, например, на конце одноцепочечного РНК-генома бактериофага Qβ, причем для его репликации вирусная РНК-полимераза нуждается в помощи бактериальных белков («Proceedings of the National Academy of Sciences USA», 1987, 84, 21, 7383—7387). В РНК-вирусах растений встречаются еще более точные аналоги — например, тРНК-подобную структуру из вируса желтой мозаики турнепса узнают ферменты бактерий, работающие с их собственными тРНК («Nucleic Acid Research», 1984, 12, 19, doi: 10.1093/nar/12.19.7467)! Другие ретровирусы, например вирус мозаики цветной капусты, используют клеточные тРНК как затравки для синтеза первой цепи ДНК на матрице РНК («Trends in Biochemical Sciences», 1985, 10, 5, doi: 10.1016/0968-0004(85)90193-8).
У этих и других вирусов репликация всегда начинается с двух гуаниновых нуклеотидов, комплементарных двум цитозинам в одноцепочечном ССА-участке тРНК-подобной структуры. Гуанин в данном случае выбран, скорее всего, потому, что он образует больше всего водородных связей как с другой цепью РНК, так и с молекулой фермента. Таким образом, аденин на самом конце РНК-матрицы не будет скопирован и должен быть достроен отдельно, подобно примитивной теломере.
И в самом деле, различные вирусные репликазы (например, бактериофага Qβ) и даже клеточные ДНК-полимеразы, доходя до конца матричной цепи, добавляют на конце растущей цепи один лишний аденин. Это особенно странно для бактериальных ДНК-полимераз, которые копируют кольцевые ДНК и в норме никогда не сталкиваются с концом матричной цепи. Еще одна странность проявляется в процессе созревания тРНК: сначала РНКаза Р обрезает концы незрелых тРНК, удаляя в том числе нуклеотиды ССА, а потом ССА достраиваются обратно другим ферментом — нуклеотидилтрансферазой.
Из всех этих фактов участия тРНК-подобных структур в репликации была построена гипотеза «геномной метки» (genomic tag hypothesis). Подробное изложение см. в сборнике «RNA World» (Cold Springs Harbor press, 1999, глава 3, http://rna.cshl.edu/content/free/chapters/03_rna_world_2nd.pdf).
Эта гипотеза утверждает, что тРНК-подобные «клеверные листы» сначала появились на концах геномных молекул в РНК-мире и служили местом начала репликации и первыми теломерами — поэтому появились и ферменты для достройки ССА-участков, и добавление неспаренного концевого аденина различными полимеразами. У тех молекул, которые должны были работать рибозимами и не участвовать дальше в репликации, фермент — предшественник РНКазы Р отрезал «клеверный лист». Этот фермент и по сей день имеет в своем составе маленькую РНК-молекулу, что говорит о его большой древности. Отрезанные «клеверные листы» накапливались, и в какой-то момент для них нашлась новая функция: они стали служить адаптерами для прикрепления аминокислот к рибозимам, причем аминокислоты пришивались к ССА-хвосту, а для связывания с рибозимами служили другие участки молекулы, в том числе будущая антикодоновая петля («Proceedings of the National Academy of Sciences USA», 1993, 90, 9916—9920).
Итак, большинство вспомогательных молекул белкового синтеза изначально имели другие функции и могли возникнуть раньше, чем рибосомы. Но как могла появиться сложно устроенная рибосома из десятков взаимосвязанных, подогнанных друг к другу молекул? Допустим, что первая рибосома обходилась без белков (на эту возможность намекает тот факт, что присоединение новой аминокислоты к цепочке до сих пор катализируется РНК). Но рибосомные РНК сами по себе очень сложны.
Изучение структуры рибосомной РНК (рРНК) показало, что она могла быть построена постепенно, путем добавления новых доменов. Это следует из распределения одного из типов связей — водородных связей между несколькими последовательными аденинами в одноцепочечном участке и гидроксилами рибозы в двухцепочечном участке. Такая связь нужна для устойчивости одноцепочечного участка, но не важна для двухцепочечного, поэтому она могла возникнуть только если одноцепочечный участок аденинов добавился после двухспирального фрагмента.
|
|
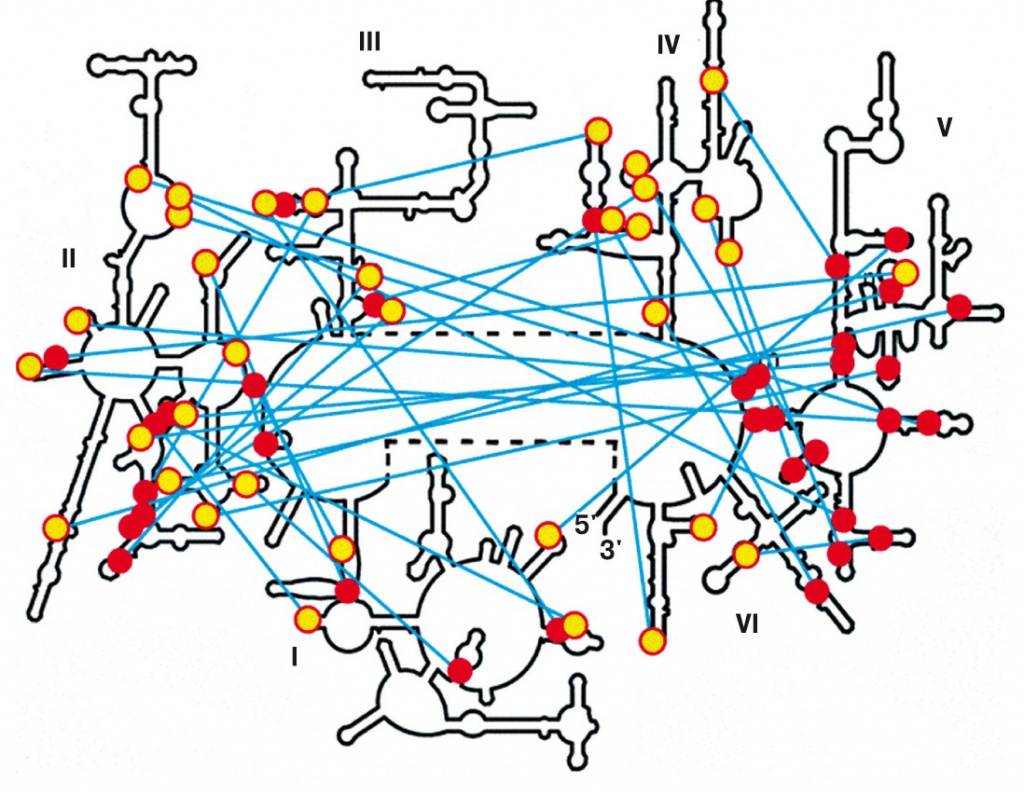
4. Направленные контакты во вторичной структуре РНК большой субъединицы рибосомы кишечной палочки |
На рис. 4 мы видим распределение таких контактов в большой рибосомной РНК кишечной палочки. Темными кружками обозначены двуспиральные участки, светлыми — адениновые односпиральные, присоединенные к ним. Видно, что многие контакты направлены к пятому домену и почти никогда — от него. Это означает, что пятый домен был древнейшим, а остальные части рибосомной РНК надстроились позже (Константин Боков и Сергей Штернберг из университета Монреаля, «Nature», 2009, 457, 977—980, doi: 10.1038/nature07749).
Как могла работать такая древняя рибосома, без белков и без части доменов рРНК? На пятом домене находится пептидилтранферазный центр рибосомы — он присоединяет новые аминокислоты к растущему пептиду. Однако этот домен не принимает участия в связывании матричной РНК и никак не может контролировать последовательность пептида. Получается, что древняя рибосома, скорее всего, синтезировала пептиды случайного состава, без участия мРНК. Мог ли такой примитивный белковый синтез как-то пригодиться в РНК-мире?
В поисках ответа исследователи обратили внимание на то, что многие белки, образующие альфа-спираль, могут неспецифически связываться с двуспиральной РНК. При этом карбонильные группы пептидной цепи образуют водородные связи с 2'-гидроксильными группами остатков рибозы, тем самым защищая РНК от многих неприятностей. С атаки на эти ОН-группы начинается гидролиз РНК щелочами, ионами металлов и ферментами РНКазами. Боковые группы аминокислот в этих контактах не участвуют, иными словами, последовательность аминокислот не так важна — пептид случайной последовательности или из повторяющихся остатков одной аминокислоты уже обеспечивает заметную защиту.
В мире РНК с появлением эффективно самокопирующихся рибозимов нуклеотиды стали дефицитным ресурсом, и некоторые рибозимы стали получать их, гидролизуя соседей. В таких условиях защитный пептид мог обеспечить большое преимущество и, что более важно, спровоцировать «гонку вооружений». «Хищные» рибозимы стали учиться расщеплять белки, «жертвы» отвечали на это изменением и усложнением состава аминокислот в защитных пептидах. На этом пути добавление любой новой аминокислоты в арсенал пептидного синтеза подхватывалось отбором. Адаптивным, видимо, был и переход от простого регулярного чередования нескольких аминокислот к сложным последовательностям пептидов, для чего пригодился матричный синтез — так появились мРНК, тРНК и генетический код.
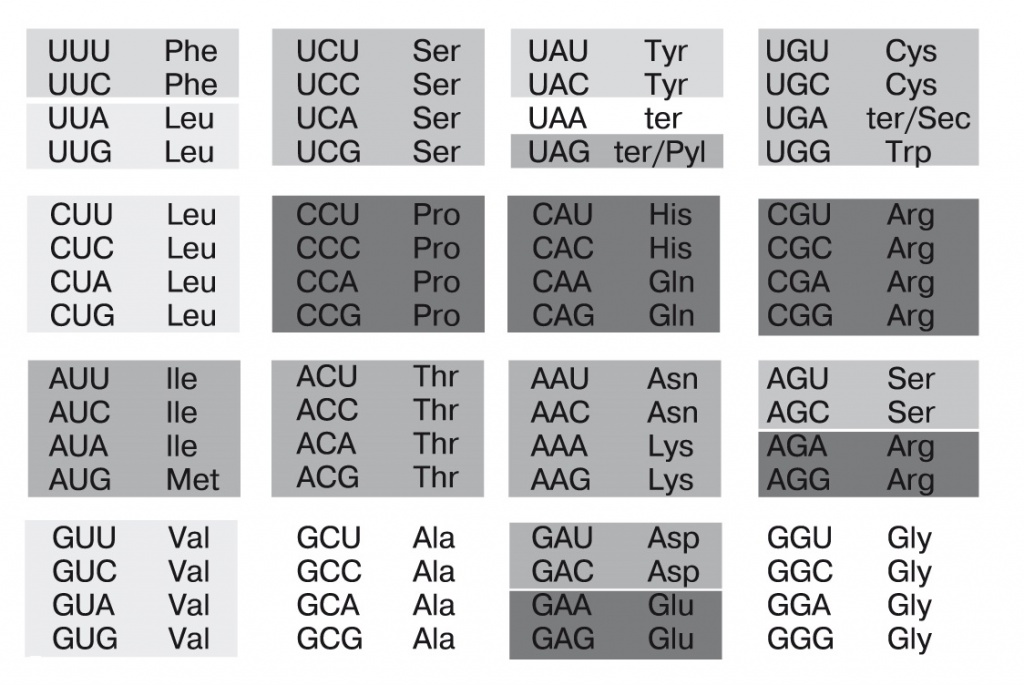
О поздних этапах развития трансляции нам может рассказать таблица генетического кода (рис. 5).
|
|
5. Современный генетический код |
Существуют три основные идеи по поводу того, как могла возникнуть связь между аминокислотами и нуклеотидными триплетами. Это «застывшая случайность», оптимизация на минимум ошибок белкового синтеза и соответствие путей биосинтеза аминокислот кодонам либо антикодонам (подробнее об этом см у Евгения Кунина, Артема Новожилова, «International Union of Biochemistry and Molecular Biology. Life» 2009, 61, 2, 99—111, doi: 10.1002/iub.146).
Теория «застывшей случайности» утверждает, что соответствие аминокислот и кодонов установилось случайно, а потом таким и осталось, потому что любое изменение нарушило бы структуру сразу многих белков и привело бы клетку к гибели. Очевидно, это почти ничего не объясняет.
Согласно теории оптимизации, генетический код устроен так, чтобы при самых частых ошибках трансляции аминокислоты заменялись на химически похожие. Ошибки трансляции происходят при неточном соответствии кодона мРНК антикодону тРНК. При этом не все теоретически возможные ошибки имеют одинаковую вероятность: так, ошибка в третьем нуклеотиде вероятнее, чем в первых двух; перепутать A с G или U с C проще, чем пурины с пиримидинами. Как видно из таблицы генетического кода, многие аминокислоты кодируются четырьмя кодонами — тогда последний нуклеотид вовсе не важен, он может быть любым.
Подсчитано, что базовый генетический код (тот, что использует большинство современных живых систем) по оптимальности входит в тысячную долю лучших из всех возможных кодов. Однако он не самый лучший. Например, если стоп-кодон UGA станет кодировать триптофан, помехоустойчивость кода возрастет.
Именно такие изменения кода происходят в малых геномах, например геномах митохондрий. Так что на генетический код влияли и другие факторы, кроме оптимизации помехоустойчивости.
Теория стереохимического соответствия утверждает, что кодоны (или антикодоны) способны специфически связывать свои аминокислоты, и это дало начало генетическому коду. Действительно, в экспериментах по отбору РНК, эффективно связывающих аминокислоты, полученные молекулы были обогащены как кодонами, так и антикодонами этих аминокислот. К сожалению, обогащение не обнаружено при попытке создать РНК, связывающие самые простые аминокислоты (глицин, аланин, серин, аспартат).
Конечно, сборка пептида из аминокислот, связанных напрямую с кодонами мРНК, невозможна, — аминокислоты были бы слишком далеко друг от друга, чтобы образовать пептидную связь. Скорее предковые кодоны принимали участие в биосинтезе аминокислот («Biology Direct», 2008, 3, doi: 10.1186/1745-6150-3-37).
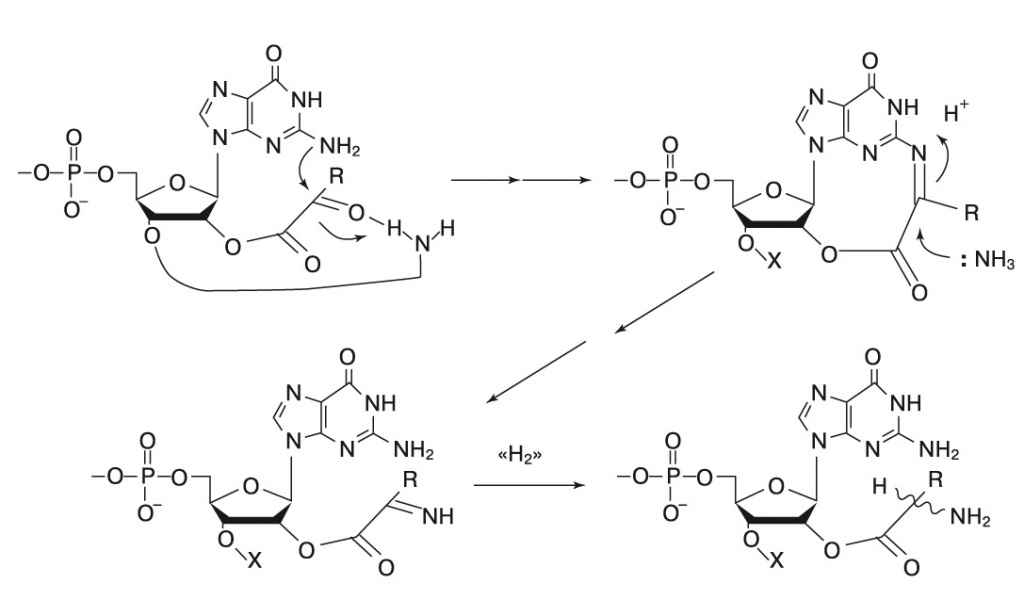
Пути биосинтеза аминокислот действительно коррелируют с кодонами. Например, три аминокислоты, синтезируемые в одну стадию из альфа-кетокислот — аланин, аспартат и глутамат, — все имеют кодоны, начинающиеся с G. В одной из лучше разработанных версий теории («Proceedings of the National Academy of Sciences USA», 2005, 102, 12, 4442—4447, doi: 10.1073/pnas.0501049102) это объясняется следующим образом. Синтез аминокислот происходил после присоединения молекулы-предшественника — альфа-кетокислоты — к 2'-гидроксилу рибозы, входящей в состав некой молекулы РНК, первые три нуклеотида которой дали начало кодону. В этом случае аминогруппа гуанина оказывается как раз на подходящем расстоянии, чтобы катализировать через стадию основания Шиффа восстановительное аминирование альфа- кетокислоты, и в результате получается аминокислота (рис. 6).
|
|
6. Восстановительное аминирование альфа-кетокислот при помощи гуанина. Он выступает в роли катализатора и, возможно, поэтому оказывается первым кодоном для аминокислот, которые синтезируются таким путем. Кривой линией в первой формуле и буквой Х в остальных обозначен второй нуклеотид
|
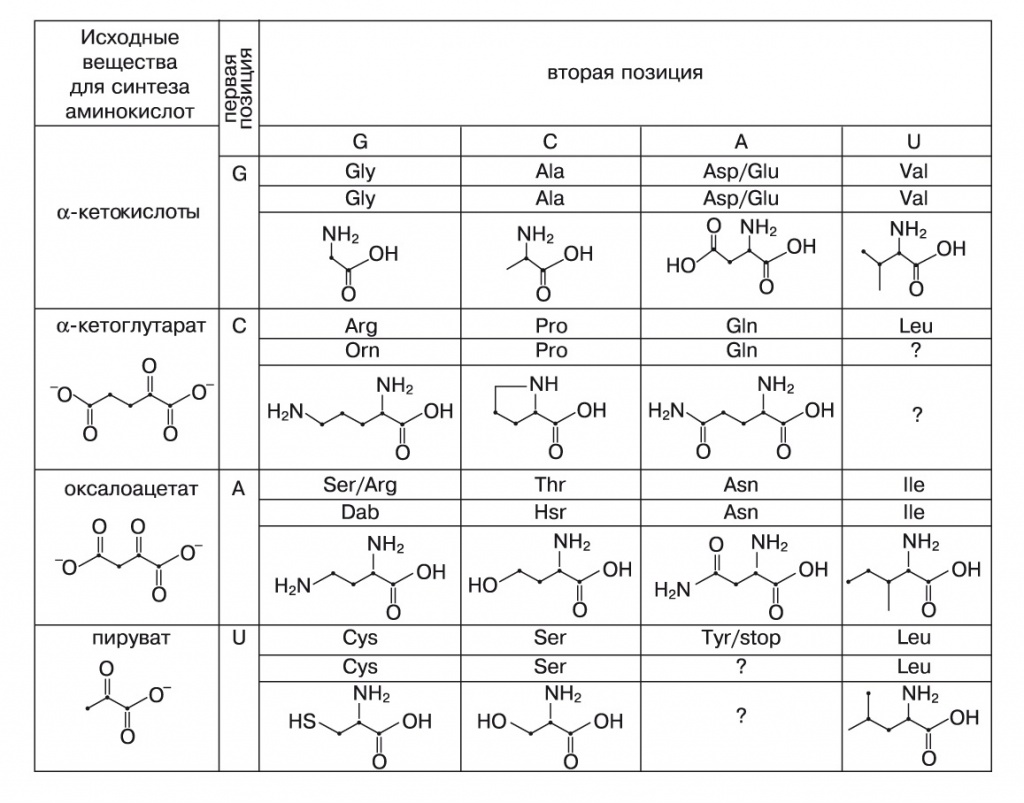
Синтез других аминокислот проходит во много стадий и начинается с фосфорилирования будущей боковой цепи. Так, аминокислоты, происходящие из оксалоацетата, — аспарагин, треонин, изолейцин — имеют кодоны, которые начинаются на А, происходящие из альфа-кетоглутарата — аргинин, пролин, глутамин, — на С, из пирувата — цистеин, серин, лейцин, — на U. Фосфорилирование катализируется аминогруппами этих нуклеотидов, причем расстояние от 2'-гидроксила до аминогрупп разных нуклеотидов как раз соответствует трем разным кислотам-предшественникам. Дальше, по этой теории, в игру вступает второй нуклеотид (подробности в подписи к рис. 7).
|
|
Первый нуклеотид кодона — G, если, чтобы получить аминокислоту, нужна реакция восстановительного аминирования альфа-кетокислот (см. рис. 6), а если требуется фосфорилирование — C, A или U, в зависимости от размеров молекулы-предшественника. Второй нуклеотид направляет дальнейшие реакции. Например, в случае альфа-кетоглутарата, если второй — А, он своей аминогруппой катализирует амидирование концевой карбоксильной группы и аминирование кетогруппы, давая начало глутамину. В случае C или G во второй позиции сначала происходит (с неким дополнительным катализатором) восстановление концевой группы до альдегидной, дальше С аминирует альфа-кетогруппу, продукт циклизуется, и двойная связь восстанавливается — получается пролин. G может восстановительно аминировать концевую альдегидную группу с образованием орнитина (Orn), которая предшествует аргинину в современном биосинтезе и могла ранее входить в состав белков. По этим данным реконструируется древний вариант генетического кода. Dab — диаминобутановая кислота, Hsr — гомосерин |
Так, на основе чисто химических закономерностей мог возникнуть примитивный двухбуквенный генетический код. Здесь третий нуклеотид еще ничего не кодирует, аспартат и глутамат не различаются, а кодон AG, в современном коде — спорная территория, захваченная и поделенная серином и аргинином, кодировал другую аминокислоту, ныне исчезнувшую. Возможно, это был диаминобутират — аминокислота, похожая на орнитин и лизин, но с более короткой боковой цепью. Кодон CU в современном коде занят лейцином, членом семейства пирувата, которому по теории положен кодон UU. Видимо, CU раньше тоже принадлежал вымершей аминокислоте или был стоп-кодоном. Стоп-кодоном, скорее всего, был и UA.
Это выглядит красиво и логично, но, к сожалению, это не единственная теория такого плана. Хуже того, альтернативные теории находят аргументы в пользу участия антикодоновых нуклеотидов в синтезе аминокислот. Так что полной ясности в этом вопросе пока нет.
Элементы жизни: почему не кремний и не фтор
Фотохимия и «черные курильщики»
Пути восстановления углекислого газа
Происхождение белкового синтеза и генетического кода
Мир вирусов, последний общий предок и происхождение ДНК
Происхождение мембран и мембранной биоэнергетики
Закат «цинкового мира», прокариотная биосфера и происхождение фотосинтеза
