Люди и мыши против туберкулеза
Микробы носятся в воздухе
Воздух полон микробов, в том числе патогенных. Их вдыхают многие, но заболевают не все, а у тех, кто заразился, болезнь протекает по-разному: иногда вяло тлеет десятилетиями, а бывает, что сводит пациента в могилу всего за несколько месяцев. Все сказанное в полной мере относится к туберкулезу. Успехам в борьбе с ним мы обязаны антибиотикам, появившимся в середине ХХ века, но возбудитель болезни, бактерия Mycobacterium tuberculosis, за эти годы выработал устойчивость к лекарствам. В разных регионах России к антибиотикам устойчивы от 10 до 40 % штаммов M. tuberculosis. Туберкулез — мировая проблема, ежегодно от этой болезни умирают два миллиона человек. Нам же остается уповать на то, что специалисты разработают новые лекарства, а также на способность нашего организма сопротивляться болезни.
Противоборство микобактерий и человека подобно весам, на одной чаше которых — вирулентность возбудителя и его умение уходить от иммунного ответа, а на другой — устойчивость организма-хозяина, то есть врожденный и адаптивный (приобретенный) иммунитет. Малейшее их колебание изменяет ход болезни.
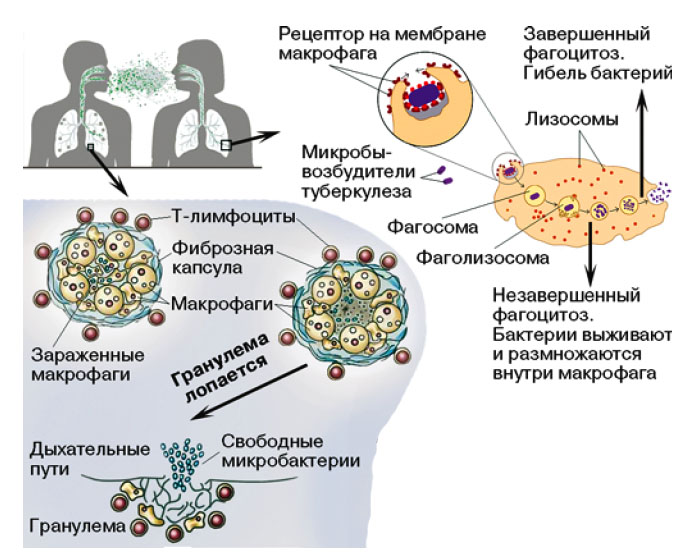
|
| 1. Судьба Mycobacterium tuberculosis в организме хозяина. Бактерию, попавшую в организм, заглатывают фагоциты. В этих клетках бактерия или погибнет, или сама погубит клетку-хозяина, или годами будет существовать в изолированных гранулемах |
Бактерии попадают в организм воздушно-капельным путем (рис. 1). Сначала они окажутся в легких, где будут медленно делиться и, пока их немного, останутся почти незаметными для иммунной системы. В течение начальной фазы инфекции, инкубационного периода, который длится от четырех до двенадцати недель, туберкулезная палочка привлекает внимание исключительно клеток врожденного иммунитета — фагоцитов. Способностью к фагоцитозу обладают разные типы клеток. Первыми на место являются нейтрофилы, но их возможности уничтожать микобактерии ограниченны, и тогда за дело берутся макрофаги — самые древние клетки иммунной системы. Фагоцитоз происходит так: сначала клетки фиксируют микобактерии на мембране, затем этот участок мембраны погружается в цитоплазму фагоцита и образует фагосому — мембранный пузырек, содержащий возбудитель туберкулеза. Фагосома сливается с лизосомами, которые наполнены ферментами, переваривающими бактерии, и они постепенно разрушают M. tuberculosis. Если вирулентность возбудителя невысока, его существование в организме на этом заканчивается. Однако микобактерии, обладающие значительной вирулентностью, синтезируют факторы, которые мешают лизосомам сливаться с фагосомами; их ферменты не могут воздействовать на поглощенные бактерии, и возбудители туберкулеза, факультативные внутриклеточные паразиты, беспрепятственно размножаются внутри макрофага. В конце концов зараженный макрофаг погибает, а размножившиеся микобактерии оказываются во внеклеточном пространстве. Там их уже поджидают новые фагоциты, и цикл повторяется. Когда макрофаги погибают, из них вытекают ферменты, повреждающие ближайшие клетки. В результате в легких больного врачи наблюдают очаги распадающейся ткани, некроз, скопление гноя, воспаление, большое количество нейтрофилов.
Но возможен и третий вариант. Если ответ иммунной системы и вирулентность возбудителя сбалансированы, то бактерии остаются в макрофагах и организм изолирует очаг инфекции, образуя гранулемы. Гранулемы представляют собой упорядоченные скопления макрофагов и лимфоцитов, окруженных плотной фиброзной капсулой. В таком состоянии M. tuberculosis могут находиться десятилетиями, пока что-нибудь, например другая болезнь, старение или иммунодефицит (больные СПИДом болеют туберкулезом в 800 раз чаще) не повлияет на состояние иммунной системы. Тогда гранулема прорывается, и микобактерии вылетают в дыхательные пути.
Похвальное слово мышам
Сопротивляемость нашего организма и вирулентность патогена определены генетически. Их противостояние — это битва геномов, и, если мы хотим ее выиграть, без генетиков нам не обойтись. А любое генетическое исследование начинается с выбора адекватного модельного объекта.
И вот вопрос: на ком же нам изучать человеческие болезни? Люди для этого решительно не годятся, потому что генетические исследования предполагают постановку скрещиваний и анализ многочисленного потомства. А вот мышь для исследования генетики устойчивости к туберкулезу подходит очень неплохо. Не все с этим согласятся, многие специалисты идею исследовать человеческие болезни на мышах не одобряют в принципе. Они говорят, что мыши — не люди, и гены у них не те, и генетическое разнообразие меньше. Мыши действительно не люди, с этим не поспоришь, однако генетическое сходство между двумя видами достигает 85%, а что касается генетического разнообразия, то с 1910 по 2003 год специалисты в разных лабораториях получили только селекционным путем несколько тысяч линий мышей, и исследователь может выбрать то, что ему нужно, было бы желание.

|
| 2. Мыши с разной степенью устойчивости к Micobacterium tuberculosis: белые A/SnYCit (A/Sn) и черные C57BL/6JCit (B6) устойчивы, пятнистые I/StSnEgYCit (I/St) чувствительны |
Именно с мышами много лет работают специалисты лаборатории иммуногенетики НИИ туберкулеза РАМН под руководством доктора биологических наук, профессора Александра Соломоновича Апта. Исследователи выбрали две линии животных, I/St и А/Sn, которые после заражения туберкулезом в высокой дозе гибнут в разные сроки: чувствительные мыши I в среднем за 25 дней, устойчивые А — за 50 (рис.2). Причем у чувствительных мышей клиническая картина заболевания очень похожа на человеческую: очаги распадающейся ткани в легких, некроз, скопление гноя, воспаление и большое количество нейтрофилов. У них даже гипоксия в легких развивается, как у больных туберкулезом. Резистентность, или восприимчивость, к туберкулезу совпадает со скоростью размножения микобактерии, у животных чувствительной линии на третьей неделе после заражения в селезенке и в легких бактерий на полтора порядка больше.
Так что скептики зря беспокоятся, туберкулез у мышей протекает так же, как у людей, надо только правильно выбрать линию. Подавляющее большинство лабораторий ничего подобного не видят, поскольку упорно работают с самой распространенной линией мышей C57Bl/6J, у которой резистентность к M. tuberculosis гораздо выше, чем у линии I. Вообще, деление на устойчивых и чувствительных к туберкулезной инфекции мышей условно. Все мыши, независимо от генотипа, восприимчивы к M. tuberculosis, и речь идет только о времени, которое проходит от заражения до гибели животных.
Туда и обратно
Итак, у исследователя есть тщательно выбранная линия мышей. Перед ним стоит задача отыскать гены устойчивости к туберкулезу. Как ему действовать? Исследователь может предпочесть методы прямой или обратной генетики.
Основной подход прямой (классической) генетики — от признака к гену; обратная действует наоборот — изменяет ген и наблюдает за изменением признака. Исследователь, решивший идти вторым путем, замечает в природе некий фенотип, допустим чувствительность к инфекции, предполагает, какими генами он может быть обусловлен, а затем проверяет свою гипотезу. Чаще всего у мыши полностью отключают (нокаутируют) предполагаемый ген и смотрят, какие функции при этом нарушены и какие биохимические пути ответственны за эти изменения.
Обратная генетика стала возможной благодаря двум достижениям конца 1980-х годов: биологи научились культивировать эмбриональные стволовые клетки мышей, из которых можно получить яйцеклетки, и вводить в их геном мутантные последовательности. Современная техника нокаута и знания о мышином геноме позволяют отключить почти любой ген, а затем, если результат впечатляет, поискать последовательность с аналогичными функциями в геноме человека. В качестве примера можно привести работу, выполненную французскими генетиками Лораном Абелем и Жаном-Лораном Казановой (Медицинская школа Неккера, Париж). Поработав с мышами, ученые проанализировали последовательности ДНК людей, которые неожиданно и очень тяжело заболевали в раннем детстве после прививки БЦЖ. Эту вакцину делают из ослабленной коровьей туберкулезной палочки M. bovis — бациллы Кальметта — Герена (bacillus Calmette-Gurin, BCG, по-русски БЦЖ). Исследователи идентифицировали гены человека, продукты которых участвуют в защитном противотуберкулезном иммунном ответе: гены, кодирующие интерферон-гамма и молекулу STAT1, которая необходима для проведения сигнала интерферона; интерлейкин-12— один из ключевых белков, запускающих синтез интерферона-гамма, и рецептор к интерлейкину-12. Мутации по этим генам вызывают восприимчивость к бактериям, которые в норме не патогенны.
Несмотря на впечатляющие результаты обратной генетики, у этого метода есть существенные недостатки. Прежде всего, это — искусственная система. В популяции крайне редко встречаются мутации, которые полностью блокируют какой-то биохимический путь. Организм с таким нарушением либо очень быстро погибает, а то и вовсе не рождается, либо включает альтернативные обходные пути. Поэтому, нокаутируя ген, мы чаще узнаем не его функцию, а то, как организм умеет обходить это нарушение. Нам же интересны реально существующие мутации, вызывающие болезнь, а не смерть.
Еще один недостаток обратной генетики заключается в том, что она не очень-то способствует истинным открытиям. Прежде чем нокаутировать ген, исследователь должен сообразить, какой именно. Логично предположить, что за восприимчивость к болезням отвечают гены, которые обеспечивают работу иммунной системы, например гены интерферона или интерлейкина-12. Предположили, отключили и убедились в том, что их гипотеза верна. Да кто бы сомневался!
Но за устойчивость к туберкулезу отвечают и другие гены, не связанные с работой иммунной системы, и сложно даже представить, какие именно, поскольку фантазия природы изощреннее, чем у любого ученого. Выявить эти гены можно только методами классической генетики: сначала описываем новый фенотип, потом выясняем, сколько генов за него ответственны, где они находятся и какие функции выполняют. Один из необходимых этапов такого исследования — получение конгенных линий животных.
Конгенные мыши отличаются от исходной родительской линии единственным фрагментом хромосомы, который они получили от животного другой линии. Например, в генотипе мышей, устойчивых к туберкулезу, один фрагмент ДНК заменен на кусочек той же хромосомы, взятый из генома чувствительной линии I. Тогда все отличия новой линии от устойчивой будут обусловлены именно этим фрагментом и генами, которые в нем находятся. Задача исследователя — выйти на конкретный ген, поэтому чем меньше донорский фрагмент, тем линия ценнее.
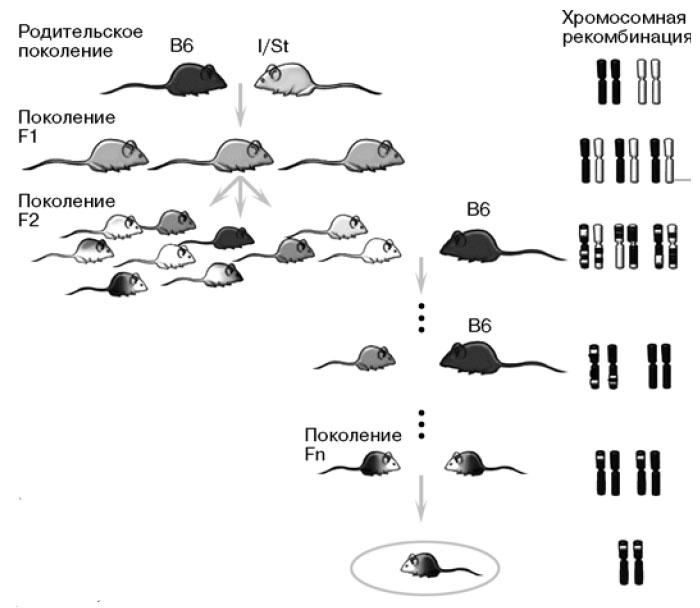
|
| 3. Получение конгенных линий. После многократных скрещиваний удается получить мышей, генетически почти полностью идентичных одной из родительских линий. Только маленький кусочек хромосомы у них от другого родителя |
Процесс получения конгенной линии трудоемок и занимает 2,5—3 года (рис. 3). Скрещивают животных двух родительских линий, которые отличаются по интересующему нас признаку, например по времени жизни после заражения микобактериями или по скорости потери веса. При образовании половых клеток гомологичные хромосомы обмениваются участками, поэтому геном потомков второго поколения будет представлять собой «нарезку» из хромосом родительских линий. Из них снова отбирают животных с нужным фенотипом и скрещивают с устойчивыми животными. Эту процедуру повторяют до тех пор, пока не добьются нужного результата. Чтобы понять, от какого родителя пришли разные хромосомные фрагменты и какой из них нас интересует, используют генетическое картирование, в частности микросателлитное. Микросателлитные маркеры — повторы ДНК, чаще всего нуклеотидные пары ГЦ, случайным образом распределенные по геному. У одной мыши в определенном локусе сидит повтор, допустим, из трех пар ГЦ, а у другой — из десяти. Микросателлиты маркируют геном подобно штрих-коду, и благодаря им ученые определяют происхождение того или иного участка хромосомы.
В лаборатории иммуногенетики НИИ туберкулеза получают конгенные линии мышей, которые имеют генотип резистентной линии В6 и фрагмент 17-й хромосомы из чувствительной линии I/St. Оказалось, что с этим фрагментом сцеплен признак тяжелого течения болезни (рис.4).
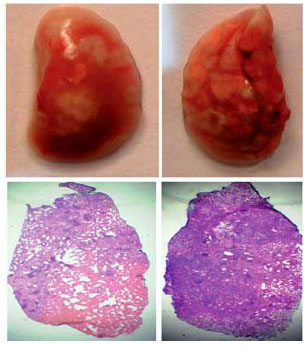
|
| 4. Легкие устойчивых (слева) и чувствительных к туберкулезу мышей, зараженных микобактериями. У мышей с тяжелым течением болезни сильнейшее гнойное воспаление легких. На срезах легких видно, что у устойчивых мышей (слева внизу) еще есть просветы в легких, а у чувствительных уже нет — они умирают. |
Что это за ген, пока неизвестно, но ученые полагают, что он контролирует широкий спектр ответов на инфекцию, и животные, мутантные по этому гену, должны быть особо восприимчивы ко многим болезням, не только к туберкулезу.
А вот еще пример успешного применения методов прямой генетики. Игорь Крамник, российский ученый, ныне работающий в Бостоне, клонировал ген Ipr1 (intracellular parasite resistance 1), расположенный в 1-й хромосоме. Ген кодирует внутриядерный белок, который усиленно синтезируется в зараженных макрофагах. Этот белок связывается с участками ДНК, которые не кодируют белков и впрямую не регулируют работу генов. Функция его непонятна, однако на восприимчивость мышей к туберкулезу он, бесспорно, влияет.
Очевидно, что регуляторы инфекционного иммунитета с неустановленным механизмом действия методами обратной генетики искать невозможно.
Защита от слабых
В 80-х годах прошлого века специалисты Университета Мак-Гилла (Канада) картировали первый ген, контролирующий восприимчивость мышей к инфекции. Сначала он получил название Bcg, потом Nramp1 (от английского Natural-Resistance-Associated Macrophage Protein 1 gene — ген макрофагального протеина 1, ассоциированного с естественной резистентностью), а сейчас, по универсальной номенклатуре, он называется Sc11a1. В 1993 году канадские исследователи определили его последовательность. Ген Sc11a1 имеет два аллеля: доминантный R (резистентный) и рецессивный S (чувствительный). Он отвечает за восприимчивость к низковирулентным бактериям, например БЦЖ. Для устойчивых животных бацилла Кальметта — Герена опасности не представляет, а чувствительные мыши с генотипом SS, заразившись ею, болеют очень тяжело, со всеми симптомами настоящего туберкулеза.
Белок Sc11a1 длиннющий, в нем больше 1000 аминокислот. Он сидит на мембране фагосом и выкачивает из них ионы двухвалентного железа. Как мы помним, фагосомы — это те вакуоли, в которых оказываются проглоченные макрофагами микобактерии. Если их не обеспечить железом, бактерии погибнут. У мышей, восприимчивых к M. bovis и БЦЖ, этот насос испорчен, железо не откачивает, поэтому проглоченные бактерии получают его в достаточном количестве и успешно размножаются.
Этот защитный механизм, весьма эффективный, почти бесполезен при заражении высоковирулентными возбудителями настоящего туберкулеза. M. tuberculosis обладают факторами, которые позволяют им проникать через мембрану фагосомы в цитозоль, где железа сколько угодно, поэтому им абсолютно безразлично, выкачивает хозяин железо из фагосомы или не выкачивает. Для них фагосома не тюрьма, а средство доставки в клетку, где они бурно размножаются. Через несколько дней вирулентные бактерии доводят зараженную ими клетку до некроза, выходят из нее в бронхи и разлетаются с брызгами мокроты в поисках нового хозяина.
Спрашивается, почему за сотни тысяч лет совместной эволюции хозяин не выработал защитные механизмы, которые препятствуют выходу M. tuberculosis из фагосомы? А потому, что при исправной иммунной системе он может извлечь выгоду из этой ситуации, поскольку получает дополнительную возможность контролировать численность возбудителя. Макрофаги, в которых находятся бактерии, стимулируют Т-лимфоциты, представляя им антигены проглоченных клеток. Если антиген находится в фагосоме, его можно представить только одному классу Т-клеток, CD4+, и они вырабатывают факторы, необходимые для образования стенки, окружающей гранулему. Антигены бактерии, вышедшей в цитозоль, активируют Т-клетки CD8+, которые содержат ферменты, убивающие микобактерии, то есть клетка включает еще один защитный механизм. Такой вот баланс интересов.
Случай с геном Sc11a1 наглядно демонстрирует, что механизмы устойчивости к высоко- и низковирулентным штаммам находятся под контролем разных генов. В этом можно убедиться на примере еще одной микобактерии, возбудителя птичьего туберкулеза M. avium. Эта бактерия условно патогенна для взрослого здорового человека, но смертельна для больных СПИДом и опасна для пожилых людей и маленьких детей.
В лаборатории иммуногенетики заразили возбудителем птичьего туберкулеза разные линии мышей. Оказалось, что мыши I/St, которые очень чувствительны к инфекции М. tuberculosis и после заражения мрут как мухи, спокойно живут с бактерией птичьего туберкулеза. А мыши линии В6, устойчивые к вирулентному штамму, погибают от слабенького M. avium (см. таблицу).

|
|
Восприимчивость к высоко- и низковирулентным штаммам зависит от разных генов |
При этом ткани всех умерших мышей выглядят одинаково, независимо от того, какая микобактерия вызвала болезнь: у них крупные очаги некроза в легких, отеки, приток нейтрофилов. И напротив, у мышей, зараженных тем возбудителем, к которому они устойчивы, следов болезни немного.
Оказалось, что восприимчивость к низковирулентной бактерии M. avium во многом зависит от аллелей гена Sc11a1. У мышей I/St, чувствительных к обычному туберкулезу, но устойчивых к птичьему, присутствовал аллель Sc11a1R, который обеспечивает устойчивость к низковирулентым микобактериям. Даже одна его копия на несколько порядков снижала количество M. avium, по-видимому, из-за того, что они были заперты в фагосомах и страдали от нехватки железа. А мыши В6 с генотипом Sc11a1S/S предоставляли возбудителю избыток железа внутри фагосом и очень тяжело переносили инфекцию. Течение обычного туберкулеза зависит от других генов, которые не влияют на размножение M. avium, поэтому хозяин может быть резистентным к одной инфекции и чувствительным к другой.
Ну кто бы мог предположить, что на чувствительность к инфекции влияет работа внутриклеточного ионного насоса! Хотя если бы приверженцы обратной генетики догадались, в чем дело, и отключили Sc11a1, они бы получили нужный результат, поскольку аллель S представляет собой нонсенс-мутацию, то есть нокаутированный ген.
О пагубном пристрастии к нейтрофилам
Устойчивость к инфекциям исследуют не только на животных, но и на клеточных культурах. Например, специалисты Университета Мак-Гилла, изучавшие ген Sc11a1, использовали культуру макрофагов. Подобно случаю с мышами, этот метод имеет много противников, уверяющих, что клетки в культуре ведут себя совсем не так, как в живом организме. Иногда это происходит оттого, что культура выбрана неправильно. Специалисты Института туберкулеза работают с культурой легочных макрофагов. Эти клетки, и только они, воспринимают инфекцию так же, как их хозяева-мыши. Макрофаги из легких восприимчивых животных чувствительны к M. tuberculosis, из резистентных — резистентны. (Макрофаги из перитонеальной полости ведут себя наоборот, а макрофаги из костного мозга вообще одинаковы.) Ученые обнаружили, что в легочных макрофагах из чувствительных к туберкулезу инфицированных мышей повышена экспрессия интерлейкина-11 (ИЛ-11). Она выше, чем в легочных макрофагах из незараженных чувствительных и зараженных резистентных животных. Содержание мРНК ИЛ-11 тем выше, чем быстрее худеют зараженные животные: скорость потери веса — один из показателей тяжести болезни.
ИЛ-11 — белок, о действии которого известно очень мало. Имеющиеся сведения противоречивы: по некоторым данным это противовоспалительный цитокин, по другим — провоспалительный. Но никто не ожидал, что его синтез связан с чувствительностью к туберкулезу. Причем в клетках чувствительных мышей активнее синтезируется не только ИЛ-11, но и факторы, регулирующие миграцию нейтрофилов. Эти фагоцитирующие клетки первыми прибывают на место обнаружения возбудителя инфекции и начинают его заглатывать. В легких больных туберкулезом людей и мышей всегда много нейтрофилов.
Анализируя состояние легких больных животных, ученые обратили особое внимание на то, что тяжесть туберкулезной инфекции связана с повышенным количеством нейтрофилов. Атака нейтрофилов — стандартная реакция организма на инфекцию, и, когда мы имеем дело с бактериями, живущими вне клетки, этот подход себя оправдывает. Но высылая нейтрофилы на борьбу с внутриклеточными паразитами, хозяин, по мнению исследователей, совершает большую биологическую ошибку. Микобактерии внутри нейтрофилов хотя бы ненадолго (потому что нейтрофилы быстро гибнут) попадают как бы в защитный кокон. Этот феномен хорошо иллюстрирует ситуация, когда полицейские, прибывшие по вызову, оказались лучшими друзьями нарушителей порядка.
Если нейтрофилы, которые непременно являются в ответ на любую инфекцию, в данном случае только мешают, лучше уменьшить их количество, ослабив приманивающий их сигнал. Исследователи попробовали связать излишек ИЛ-11 в организме больных животных. Для этого зараженным мышам в начальной фазе инфекции несколько раз ввели специально полученные антитела к ИЛ-11. Это сработало: в легких мышей, которым вводили антитела, было в два-три раза меньше микобактерий и достоверно меньше нейтрофилов, чем у зараженных, но нелеченых животных. Кроме того, введение антител к ИЛ-11 снижает воспаление и активность гена ИЛ-11: получается, что его работа зависит от количества синтезируемого белка. А активность гена влияет на течение инфекции. Однако делать выводы о возможном использовании антител к ИЛ-11 для снижения воспаления у пациентов, больных туберкулезом, преждевременно.
Почти как люди
Все эти результаты чрезвычайно интересны, но они получены на мышах. Можно ли применить их к людям? Видимо, можно, поскольку мутации в ортологичных генах человека и мыши, то есть генах, кодирующих один и тот же белок, приводят к сходным иммунологическим расстройствам. Мы уже говорили об этом, когда обсуждали методы обратной генетики и перечисляли гены, найденные у людей после работы с мышами. А вот еще один пример.
Эта история началась с того, что специалисты в Университете Мак-Гилла получили линию мышей BXH-2, чувствительную к M.tuberculosis из-за нарушений работы иммунной системы. Для низковирулентных бактерий, в том числе БЦЖ, они также уязвимы. Ученые определили, что оба дефекта вызваны мутацией в одном локусе, расположенном на хромосоме 8. Это ген Icsbp/IFR8, который контролирует работу генов, отвечающих на сигнал гамма-интерферона. Мутация в нем приводит к тому, что организм практически не образует некоторые виды фагоцитов и не реагирует на проникновение инфекции.
Недавно эти данные позволили установить причину нового синдрома у человека. В коллекции ДНК людей, тяжело болевших после прививки БЦЖ, обнаружили несколько образцов, несущих мутации в гене IRF8. Последствия оказались такими же, как у мышей BXH-2: у больных людей отсутствовали некоторые типы фагоцитов, у них развивался тяжелый иммунодефицит и они оказывались беззащитны даже перед бактериями, обычно не патогенными.
Так что многие расстройства, которые сходно проявляются у мыши и человека, вызваны мутациями в ортологичных генах. Определив ген, можно узнать, как он влияет на развитие болезни, и попробовать скомпенсировать дефект. Иногда можно ввести больному продукт этого гена или его аналог, попробовать активировать альтернативный биохимический путь, активировать или отключить сам ген или гены, которые регулируют его работу. Поэтому правильно выбранные линии мышей — важный инструмент исследования болезней человека.
Статья написана по материалам лекции А.С.Апта на зимней школе «Современная биология & Биотехнология будущего» (Пущино, январь 2013 года).
