Ошибки, ведущие к взрыву
Реакция серебряного зеркала — одна из наиболее привлекательных в химии, поскольку с ее помощью можно быстро получить красивую серебристую поверхность на стекле. Для реакции необходим реактив Толленса — водный раствор аммиаката серебра, который окисляет водный раствор альдегида (обычно глюкозы). Этот реактив больше 100 лет (со времен химика-классика Б. Толленса (1841–1918 ), именем которого он и назван) используют в практикумах по химии и в производстве зеркал.
Итак, сначала надо получить аммиакат серебра, а следующая реакция — собственно окислительно-восстановительная реакция серебряного зеркала (см. схему):
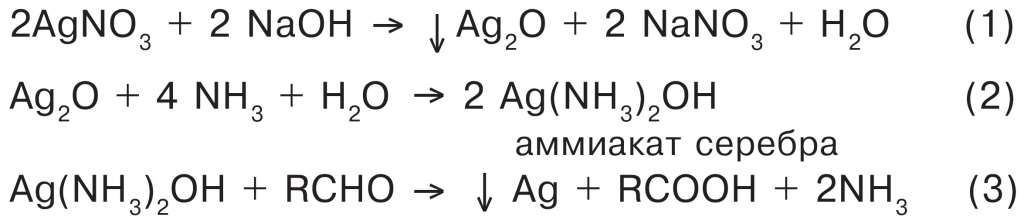
Кстати, эту методику можно легко найти в Интернете. Однако если не знать тонкости при работе с реактивом Толленса, то можно вместо красивой реакции серебрения стекла получить совершенно другие результаты. Например, недавно в датском химическом журнале появилась статья, в которой рассказывалось о том, что экспериментатор успешно приготовил реактив Толленса, который… взорвался. Оказалось, что довольно большое количество реактива Толленса (приготовленного из 20—30 г нитрата серебра AgNO3!) исследователь отложил на 10 дней. За это время из него выпал черно-коричневый осадок, а точнее, смесь амида, имида и нитрида серебра:
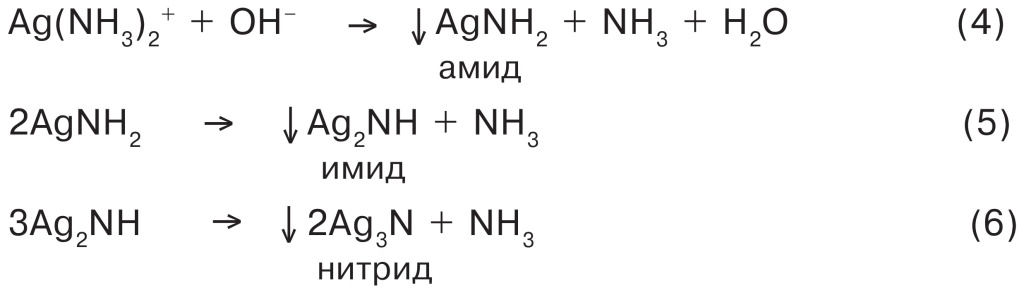
Эти азотистые соединения серебра разлагаются со взрывом с выделением металлического серебра.
Реакции (4–6) идут достаточно медленно при комнатной температуре, поэтому если использовать свежеприготовленный раствор реактива Толленса, то никаких проблем не будет. А вот хранить его нельзя. Кроме того, его нельзя нагревать, поскольку при этом ускоряются нежелательные реакции образования азотистых соединений серебра.
Есть еще одна тонкость. На реакцию по уравнению (4) сильно влияет концентрация гидроксид-иона ОН–. Поэтому для приготовления реактива Толленса можно использовать только разбавленные водные растворы щелочи NaOH и аммиака NH3 (без избытка). Если же использовать концентрированные растворы этих соединений, то довольно быстро накапливается взрывчатый амид серебра, что также приводит к взрыву. Недавно автор этой статьи столкнулся со случаем, когда реактив Толленса готовили с помощью 30%-ного водного раствора NaOH и 20–25%-ного водного раствора NH3. Результат — тяжелая травма экспериментатора.
Трудно не согласиться с автором статьи в датском химическом журнале, который призывает неподготовленных и не очень опытных экспериментаторов не браться за очень красивую, но совсем непростую реакцию серебряного зеркала.
Доктор химических наук
В.М. Власов
 |
| Иллюстрация: А. Астрин |
