Солнце всходит и заходит
 Еще древние провели демаркационную линию между животными, ведущими дневной образ жизни (диурнальными — от лат. «диес», то есть день), и никто- меральными, или ночными. Но откуда животные «знают», когда им спать, а когда бодрствовать?
Еще древние провели демаркационную линию между животными, ведущими дневной образ жизни (диурнальными — от лат. «диес», то есть день), и никто- меральными, или ночными. Но откуда животные «знают», когда им спать, а когда бодрствовать?
Попытаемся представить себе, что же такое биологические часы в современном понимании. Рассказывая о биологических часах, мы пойдем тем же путем, которым шла наука: от анатомии мозга, тех его структур, которые отвечают за сон и бодрствование, и гормонов гипофиза — к отдельным нейронам, нейромедиаторам, генам и белкам.
Где находится сон
Прошлый век начался выходом книги Зигмунда Фрейда, название которой у нас не совсем удачно перевели как «Толкование сновидений». Научный труд превратился в эдакий сонник для просвещенных людей, и по сей день у широкой публики Фрейд ассоциируется с символическим значением приснившихся полетов, вертикальных объектов и тесных комнат. Но младшего современника и соотечественника Фрейда, практикующего венского невропатолога Константина фон Экономо, интересовали не сновидения, а сон как особое физиологическое состояние. Экономо опубликовал в 1916 году статью об энцефалите (воспалении мозга), приводящем к летаргии. Исследования энцефалита вдохновили его на поиски «центра сна» в мозгу. Еще через полтора десятка лет Экономо в «Журнале нервных и умственных заболеваний» предполагал, что этот центр располагается в переднем отделе гипоталамуса («Journal of Nervous and Mental Diseases», 1930, т. 71, «Sleep as a Problem of Localization»).
В мозгу множество отделов с интересными названиями (рис. 1). Для начала запомним то, что «растет сверху» и «под» — эпифиз и гипофиз. Таламосом греки называли всякое возвышение (отсюда эпиталама, то есть торжественная песня, гимн новобрачным, восходившим на брачное ложе). Под таламосом, или таламусом (по-русски эту часть мозга так и называли бугром), располагается подбугорье, гипоталамус — орган нейросекреции и центр вегетативной нервной системы. Он регулирует эндокринные функции мозга.
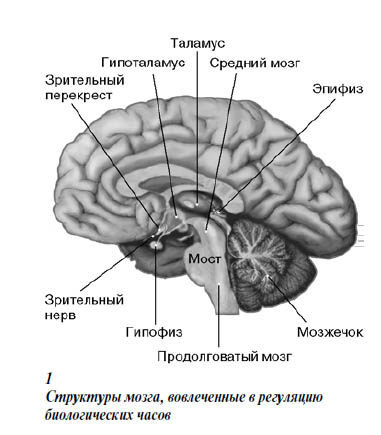
Говоря о гипоталамусе, нельзя не упомянуть хиазму, или перекрест зрительных нервов. Точно над пере- крестом лежит группа из нескольких тысяч клеток, получившая название «супрахиазмальное ядро», СХЯ (по-английски SCN — suprachiasmal nucleus). Очевидно, это и есть тот самый «центр сна», который искал Экономо. Сегодня мы знаем, что СХЯ по своей функции — то, что компьютерщики называют «хаб» (hub): узел, в котором сходятся и переправляются по назначению и зрительная информация (в том числе изменения освещенности), и обонятельные сигналы, и сигналы «голодных» нейронов, и т. д. В 1970-е годы было показано, что именно эта структура управляет суточными ритмами организма. Крысы и хомячки, у которых разрушали или удаляли СХЯ, утрачивали нормальный ритм сна и бодрствования, и более того, ритм возобновлялся, когда удаленный фрагмент ткани пересаживали обратно.
Недавно была высказана и экспериментально подтверждена остроумная гипотеза. Похоже, СХЯ управляет генными биочасами, находящимися в каждой клетке организма (о них речь впереди), причем удивительно элегантным способом — изменяя температуру тела. Если это так, то суточные колебания нашей температуры — не случайный побочный эффект, а ключевой регуляторный механизм, та самая рука, которая подводит стрелки, выставляя правильное время на всех часах («Science», 2010, т. 330, № 6002, с.379—385; научно-популярное изложение этой интересной работы можно найти на сайте «Элементы», http://elementy.ru/ news/431454). Кстати, если принудительно изменять температуру самого СХЯ, на его ритмы это не повлияет.
В разгар войны, в начале 40-х, была открыта ныне несколько подзабытая ретикулярная, или «сетевая», формация ствола мозга. Ее одно время рассматривали как главный «генератор» чередования циклов сна и бодрствования. В норме ее нейроны как бы запирают мозг на время сна, не пропуская далее в спинной те же двигательные импульсы: мы не ходим во сне, даже если нам снится, что мы идем. Она также регулирует уровень сознания (переходы от сна к бодрствованию и обратно), воздействуя на нейроны коры.
Гормоны сна и бодрствования
Концепцию циркадного ритма впервые сформулировала хронобиология. (Так называется область биологической науки, рассматривающая периодические явления у живых существ, в том числе циклы сна-бодрствования и их нарушения.) Согласно этой концепции, наш мозг следует не совсем точному суточному циклу. Эксперименты добровольцев, «замыкавшихся» в пещерах и бункерах, куда с поверхности не доносились ни свет, ни звуки, показали, что искусственный суточный ритм сна и бодрствования растягивается в среднем до 27 часов, почему и говорят о «циркадности» — подобии суток (слово происходит от лат. circa — около и dies — день). На растениях первые такие опыты провели еще в 1729 году: французский астроном Жан-Жак д'Ортуа Де Майран поместил в темную комнату гелиотроп и заметил, что его листья поднимаются и опускаются так же, как и на свету. С тех пор аналогичные опыты повторялись многократно и вполне убедили ученых, что циркадные ритмы есть у всех, включая одноклеточные организмы и клетки в культуре. Эти ритмы проявляются и в темноте, но регулируются внешними факторами (обычно изменением освещенности).
Так или иначе, ритмы нашего организма синхронизированы с вращением Земли (рис. 2). Постепенно успехи нейрохимии позволили выявить вещества, регулирующие суточные циклы у высших животных. Наверное, всем, кто слышал о циркадных ритмах, запомнилось, что эпифиз, он же шишковидная железа, выделяет гормон мелатонин. Его действие вызывает глубокий сон. Сейчас даже появились лекарства и пищевые добавки, содержащие мелатонин (в нашей стране это, например, мелаксен, мелапур), — их рекомендуют при нарушениях сна и десинхронозах, вызванных переездами. Перелетел из Москвы в Новосибирск, проглотил таблетку в одиннадцать вечера по местному времени — и спи спокойно. Примечательно, однако, что синтез и выделение мелатонина идут в темноте и блокируются на свету не только у дневных животных вроде нас, но и у тех, которые днем спят, а ночью активны, вроде малой песчанки.
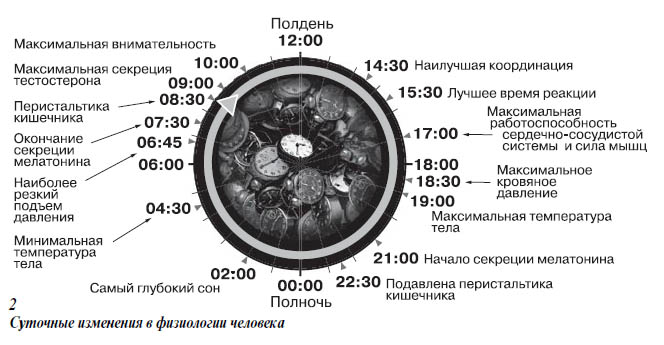
Эпифиз регулирует активность супрахиазмального ядра, а вот само СХЯ млекопитающего, по некоторым данным, приобретает свою способность «держать ритм» еще в утробе, под воздействием материнского мелатонина. Дорогие будущие мамы, врачи вам не зря советуют соблюдать режим сна...
Кроме того, бодрствование определяется синтезом и выделением таких активаторов нервных клеток, как серотонин и норадреналин. (Оба этих вещества принадлежат к классу нейромедиаторов, то есть участвуют в передаче сигнала через синапс — от одной клетки к другой.) Серотонин, он же «субстанция счастья», «гормон лидерства» и проч., синтезируется клетками, лежащими в стволе мозга. Еще дальше за серотониновыми клетками лежит группа, синтезирующая гормон активности, или гормон стресса, — норадреналин. Каждый знает, как трудно заснуть, когда ты чем-то встревожен.
Когда-то хиазма зрительных (оптических) нервов находилась в непосредственной близости от указанных двух групп нервных клеток, но затем разрастание таламуса отдалило ее от них. Однако функциональные связи с «оптической» зоной гипоталамуса сохранились. Как выяснилось, функция гормонов пробуждения заключается в подавлении активности нейронов, синтезирующих ГАМК, или гамма- аминомасляную кислоту, — главный «тормозной» нейромедиатор. Интересно, что ГАМК синтезируют клетки преоптической области гипоталамуса, само название которой напоминает о находящейся чуть позади хиазме оптических нервов. Считается, что эта непростая система, состоящая из нескольких выше упомянутых групп нейронов, отвечает за наш крепкий сон, когда мы не видим никаких сновидений. (Эта фаза сна называется non-REM, в отличие от REM, когда у спящего регистрируются быстрые движения глаз — rapid eye movements.) Пока не совсем ясно, какое отношение к этой области имеет упоминавшаяся выше ретикулярная формация...
Гены и белки
Изучение циркадных ритмов и биочасов продвигалось медленно, пока на помощь ученым не пришли методы, предвосхитившие начало геномного миллениума. Сегодня мы знаем, что каждый нейрон СХЯ — миниатюрные часы, отсчитывающие суточный ритм, и все эти тысячи часов работают в унисон, заставляя подчиняться себе остальные системы организма. Однако надо понимать, что нервный импульс представляет собой финальное крещендо длительных процессов, разворачивающихся в нейроне. Чтобы понять, что это за процессы, придется спуститься с клеточного на генный уровень.
О генах биологических часов «Химия и жизнь» уже писала («В мастерской Слепого Часовщика», 2000, № 2), но полезно будет рассказать эту историю еще раз, тем более что за десять лет добавились новые подробности.
Первые значимые открытия и тут были сделаны на любимом объекте генетиков — дрозофиле. Плодовую мушку просто содержать в лаборатории, одно поколение дрозофил сменяется за десять дней, и поэтому можно работать сравнительно быстро. На ней были хорошо отработаны методы мутагенеза и отбора мутаций, а кроме того, хотя человек и дрозофила не очень похожи друг на друга, многие наши гены имеют структурное и функциональное сходство. И активность мушки меняется в течение суток, так что по ее поведению можно судить об эффекте мутации. Хотя вся нервная система дрозофилы — это примерно сотня тысяч клеток, но и у нее позади глаз есть группа из 140—150 нейронов, ответственная за суточный ритм.
В 60-е — начале 70-х годов изучением генетики поведения дрозофилы занимался Сеймур Бензер в Калифорнийском технологическом институте. Рональд Конопка, один из его студентов, обнаружил первый ген циркадного ритма дрозофилы, локализованный в Х-хромосоме. Ген получил название period, или per. (Белок, кодируемый этим геном, соответственно назвали PER.) Ученые нашли три мутантных аллеля per, помимо нормального «дикого типа». С одним суточный цикл мушки укорачивался до 19 часов, с другим — удлинялся до 29 часов, носители третьего вообще «часов не наблюдали» — периоды покоя и активности у них имели случайную продолжительность. Похоже было, что ученые добрались до одной из главных пружин часового механизма.
Ген period клонировали и секвенировали в 1984 году Майкл Розбаш и Джеффри Холл, а также Майкл Янг в Рокфеллеровском университете. Розбаш с коллегами также заметили, что концентрация матричной РНК (мРНК) гена per возрастает и убывает в течение суток. У мутантов эти колебания ускорялись или замедлялись. В 90-е годы были открыты новые детали механизма — гены timeless, сокращенно tim, doubletime (группа Янга), а также Clock, cycle и cryptochrome (группа Розбаша).
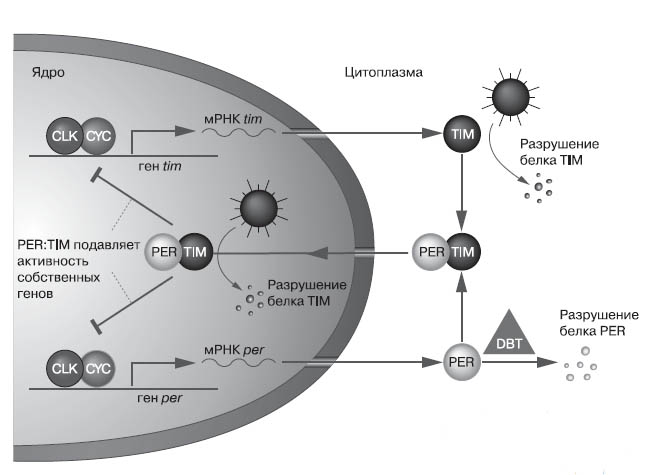
Какие непростые отношения связывают эти гены и их продукты, читатель узнает (или вспомнит), взглянув на рис. 3. Продукты генов Clock и cycle — факторы транскрипции period и timeless, то есть белки, регулирующие синтез мРНК этих генов. Молекулы матричной РНК синтезируются, понятно, в ядре, где находится ДНК, а затем выходят в цитоплазму — там они становятся матрицами для синтеза белков PER и TIM. Эти белки соединяются, образуя гетеродимер (молекулу из двух неодинаковых субъединиц). С приближением вечера этот гетеродимер входит в ядро и выключает там синтез мРНК с генов Clock и cycle — а тем самым и белков CLK и CYC, а значит, и собственных мРНК. Концентрации PER и TIM, все это время нараставшие, начинают падать, наконец, становится мало «выключателя»-гетеродимера PER:TIM, и снова активируются Clock и cycle. Круг замкнулся, начался новый день.
|
|
3. Гены циркадных ритмов у дрозофилы и их продукты (пояснения в тексте). Здесь изображены лишь главные колесики и пружины биологических часов. Более полную картину можно увидеть, например, в статье Басса и Такахаши («Science», 2010, т. 330, № 6009, с. 1349—1354)
|
А почему, собственно, концентрации PER и TIM падают? За это отвечают другие упомянутые выше гены и их белки. Известно, что деградация белка TIM быстрее идет на свету. Точнее, светом активируется продукт гена cryptochrome, белок CRY. Криптохромы — это флавопротеины (то есть белки, содержащие рибофлавиновые производные нуклеиновых кислот), чувствительные к голубому свету. Теперь известно, что криптохромы участвуют в регуляции циркадных ритмов и у растений, и у животных (а кроме того, отвечают за чувствительность к магнитному полю у некоторых видов, но это совсем другая история). И вот этот криптохром ранним утром взаимодействует с TIM и обрекает его на быстрый распад. А поскольку TIM стабилизирует своего соседа PER, тот тоже распадается. Продукт гена doubletime (DBT), видимо, фосфорилирует PER (то есть прицепляет к нему фосфатную группу) и тем самым еще ускоряет его деградацию.
Важный вопрос — какие молекулярные механизмы обеспечивают связь между световым сигналом (высшие организмы, как известно, воспринимают его глазами, а отнюдь не каждой клеткой тела) и генами биологических часов? До недавнего времени считалось, что фототрансдукция — превращение светового сигнала в электрический, передаваемый по нейронам, — может осуществляться только в сетчатке глаза и только через посредство ретиналя, активного компонента родопсина. Ученые из Калифорнийского университета в Ирвине выяснили, что такой же способностью обладает белок CRY, причем он задействует механизм, независимый от TIM и PER («Science», 2011, т. 331, № 6023, с.1409—1413). Если нейрон, в котором экспрессируется CRY (а это, например, нейроны-ритмоводители биологических часов дрозофилы), осветить голубым светом, длина волны которого соответствует чувствительности CRY, то запускается сложный каскад реакций с участием калиевых мембранных каналов и генерируется потенциал действия — нейрон под прямым воздействием света дает электрический сигнал. Контрольные опыты показали, что с опсином, зрительным пигментом дрозофилы, эта реакция никак не связана. А вот если в эксперименте заставить синтезировать CRY другие нейроны, ранее не обладавшие светочувствительностью, то они тоже начинают генерировать сигналы в ответ на вспышки света.
Стоит еще назвать ген pdf, не имеющий никакого отношения к формату электронных документов. Продукт этого гена, пептид (то есть короткий белок) под названием pigment dispersing factor, видимо, отвечает не только за распределение пигмента, но и за связь между «часами» дрозофилы и другими участками ее нервной системы — то есть именно он передает приказы от «часов» всему организму.
Здесь перечислены не все гены дрозофилы, чья роль в поддержании циркадного ритма известна к настоящему времени. И та картина, которая известна ученым, тоже, безусловно, не полна.
Мыши и люди
Аналоги мушиных генов были найдены у млекопитающих. (Важный вклад в обнаружение мышиных генов биоло- гических часов внес Джозеф Такахаши из Медицинского института Говарда Хьюза.) Дело пошло быстрее с новыми методами биоинформатики и геномными базами данных. Многие гены циркадных ритмов млекопитающих имеют те же названия, что и у дрозофилы (хотя мышиный эквивалент cycle, например, зовется Bmal1 — Brain and Muscle-like protein). Реальная схема их взаимодействия гораздо сложнее, чем рисунок 3, и мы ее не покажем, чтобы не устрашать читателя. Достаточно упомянуть, что генов per у мыши три штуки, а cryptochrome — два. У мышей с «нокаутированным», то есть выключенным, Cry1 суточный цикл укорочен, а с выключенным Cry2 — удлинен, если же выключены оба, мышь полностью теряет чувство времени.
У человека описан так называемый синдром раннего засыпания — аdvanced sleep phase syndrome (ASPS). Такие люди — «гипержаворонки», они ложатся спать засветло и просыпаются затемно. Этот синдром бывает наследственным, и недавно выяснилось, что причиной могут быть мутации в гене hРer2 (h здесь от human — человеческий). А вот противоположную напасть, delayed sleep-phase syndrome (DSPS), когда несчастная «сова» засыпает в три часа ночи и не может проснуться утром, связывают с геном hPer3. Впрочем, следует помнить, что большинство нарушений сна не являются врожденными и лечатся элементарными, всем известными правилами вроде «рано в кровать, рано вставать», «не переедайте на ночь» и «не спите при электрическом свете». В утверждении «все эти "совы" — просто лентяи» много печальной правды. Но правда и то, что есть и люди, физиологически неспособные проснуться в семь утра, и это может быть связано с генами.
Шутники, помимо «сов», «жаворонков» и «голубей» (тех, у кого циркадный цикл примерно равен суточному, кто вовремя засыпает вечером и легко просыпается утром), выделяют еще «дятлов». Это, понятно, те, кто свеж и бодр в любое время суток на зависть окружающим. Шутка шуткой, но люди, которые спят мало и при этом высыпаются, действительно существуют — такая способность была, например, у Н.В.Тимофеева- Ресовского. Исследования выявили целые семьи малоспящих (так же, как, увы, и долгоспящих — некоторые люди нуждаются в более продолжительном сне, чем другие). А раз семьи, значит, дело в генах. Два года назад у людей и мышей обнаружили ген, который ассоциируется с «фенотипом короткого сна» («Science» 2009, т. 325, № 5942, c. 825—826 и 866—870). Это оказался ген репрессора транскрипции (hDEC2- P385R, или просто DEC2), то есть белка, который подавляет активность генов. Еще раньше было известно, что белки этого семейства подавляют транскрипцию мышиного Per1, вмешиваясь в работу CLOCK:BMAL1 («Nature», 2002, т. 419, № 6909, с. 841—844). Авторы исследования оптимистично предполагают, что это открытие когда-нибудь позволит найти новые эффективные и безопасные средства для регулирования сна. И в самом деле, пора бы уже чем-то заменить феназепам и кофе.
Конечно, существуют и «тяжелые» мутации, которые нарушают сразу многое в нервной системе, в том числе и сон. У дрозофилы, например, имеется ген Shaker (подобный ген есть и у мышей), который кодирует белок калиевого канала. Название «трясущийся» ген получил потому, что у мух, усыпленных эфиром, наблюдалось характерное дрожание лапок, да и при пробуждении их двигательная способность явно была нарушена. Мухи с мутациями этого гена спали гораздо меньше, чем нормальные особи. Еще один ген — sleepless — кодирует белок, который регулирует экспрессию и работу шейкер-каналов в нервной системе дрозофилы, поэтому мутации в нем тоже приводят дрозофил к бессоннице.
У человека также найдены гены, «поломки» в которых вызывают серьезнейшие нарушения сна. Есть неизлечимая наследственная болезнь — фатальная семейная бессонница (известно примерно 40 семей, которые страдают этим заболеванием). Она развивается по доминантному типу, то есть «скрытых носителей», как, например, при гемо- филии, быть не может: если у человека есть этот ген, болезнь его не минует. Проявляется она в возрасте от 30 до 60 лет. Сначала больной страдает от прогрессирующей бессонницы, потом начинаются фобии, галлюцинации, и примерно через полтора года — слабоумие и смерть на фоне полной неспособности спать. Причина болезни — мутация в гене прионового белка PRNP. (Сам белок в нормальном виде называется PrPc, где с означает cellular — клеточный.) Если в кодоне 178 этого гена, находящегося в 20-й хромосоме, аспарагин заменен на аспарагиновую кислоту, а в позиции 129 присутствует метионин, то получается белок со свойствами при- она, образующий амилоидные бляшки в таламусе. Мутации в том же гене отвечают за наследственный синдром Крейтцфельдта — Якоба. А у представителей племени форе из Новой Гвинеи, чьи предки были каннибалами — те самые, среди которых распространена болезнь куру, чью инфекционную природу доказал Карлтон Гайдушек, — обнаружены варианты этого гена, обеспечивающие иммунитет к куру. Кстати, мутации, вызывающие фатальную наследственную бессонницу и синдром Крейтцфельдта — Якоба, описали Лев Гольдфарб с сотрудниками, работавшие у Гайдушека в Национальном институте здоровья («Science», 1992, т. 258, № 5083, с. 806—808.).
Новые факты
Эпигенетикой еще в 20-е годы прошлого века назвали изменения генов, происходящие после их воспроизведения в потомстве. Сегодня под эпигенетической модификацией понимают метилирование ДНК и гистонов (белков, на которые «наматывается» ДНК), то есть присоединение к ним метильных групп -СНз. Метилирование, а также ацетилирование (присоединение остатков уксусной кислоты) — один из важнейших регуляторных механизмов активности генов. С учетом этих фактов картина регуляции суточного ритма конечно же усложнилась. Установлено, например, что у млекопитающих молекулярные часы регулируют выработку кофермента NAD+. А он, в свою очередь, регулирует активность фермента деацетилазы, которая управляет активностью генов. Об этом рассказали в своей статье Джозеф Басс и Джозеф Такахаши, посвященной, в частности, тому, как биологические часы регулируют обмен веществ («Science», 2010, т. 330, № 6009, с. 1349—1354).
То, что метаболизм циклически изменяется в течение суток, известно было давно. А теперь известно, что суточный метаболизм клетки управляется теми же продуктами генов биологических часов, в том числе через метилирование и ацетилирование. Следовательно, десинхронозы вполне могут быть причиной нарушений обмена веществ. Мы получаем все новые данные в подтверждение этого. Например, ученые Пенсильванского университета в сотрудничестве с коллегами из Гарварда установили, что гистон-деацетилаза контролирует липидный обмен в клетках печени, причем активность этого фермента возрастает и убывает в 24-часовом цикле — то есть сама она подчинена биологическим часам («Science», 2011 т. 331, № 6022, с. 1315—1319).
На смену решенным загадкам, как это всегда бывает в науке, приходят новые. Вот лишь два примера. Владислав Вязовский («Nature», 2011, т. 472, № 7344, c. 443—447) со своими коллегами по Висконсинскому университету установил, что у крыс, которых лишали сна, отключение нейронной активности коры происходит мозаично — в ней появлялись «сонные пятна». Ученые назвали это явление «локальным сном» (local sleep). Число подобных очагов возрастает при удлинении вынужденной бессонницы, и, очевидно, поэтому крысы хуже выполняют специальные тесты. Возможно, «сонные пятна» станут еще одной перспективной моделью для изучения работы клеточных часов. А недавно было показано, что ритмическая активность характерна и для эритроцитов млекопитающих, у которых, как известно, нет собственного ядра, а значит, нет и генов биологических часов («Nature», 2011, т. 469, № 7331, c. 498—503). Что же тогда отсчитывает время для эритроцитов? Может быть, в геноме их митохондрий имеются гены, которые обладают ритмической активностью?
Многое еще нужно узнать о том, каким образом «ритмоводители» организма, подобные СХЯ, передают сигналы точного времени другим органам, как они сами подстраиваются по внешним сигналам и личным обстоятельствам особи. Интересно было бы выяснить, как влияет на циркадные ритмы РНК-интерференция. Кроме того, помимо суточных ритмов есть и другие. Биологические часы в разных типах клеток идут с неодинаковой скоростью. Например, клетки кожи и слизистой кишечника делятся каждые три дня, время между делениями клеток костей тянется годами, а некоторые стволовые клетки тимуса — главного органа иммунной системы — могут не делиться в течение всей жизни. Сегодня мы знаем, как подстегнуть деление и развитие обычных клеток кожи, чтобы получить из них индуцированные стволовые клетки. Но их потенциал не идет — по крайней мере, пока — ни в какое сравнение с эмбриональными стволовыми клетками. Так что часовых дел мастерам предстоит еще много работы.
