Химия, перпендикулярная жизни
Иголка в стогу сена
Жизнь с момента своего зарождения есть химический процесс, который идет в насыщенном мириадами различных веществ бульоне; отдаленным потомком этого бульона оказывается цитоплазма клетки. Как биологам разобраться в нем, понять поведение постоянно возникающих и исчезающих биологических молекул? Примерно с середины XX века ответ таков: надо приделать к интересующим веществам какие-то метки и затем проследить за их судьбой.
С метками особых проблем нет, ими могу быть и ярко светящиеся вещества, и магнитные частицы, и многое другое в зависимости от задач исследователя. А вот добиться, чтобы они прикрепились именно к требуемому веществу, да при этом не были разложены на составляющие системами защиты клетки, не употреблены в процессе метаболизма, не вмешались в ход жизненных процессов — это оказалось предметом высокого искусства.
Поначалу исследователи тренировались на белках. Ведь у каждого из них вполне уникальная структура, определяемая последовательностью аминокислот, причем некоторые аминокислоты используются крайне редко. Если придумать метку, которая присоединяется только к такой, редкой, аминокислоте, то удастся выловить из «бульона» лишь содержащие ее белки. Это, конечно, не находка иголки в стогу сена, но способ сократить стог до охапки.
Несколько десятилетий исследователи совершенствовали этот подход и не без успеха, например, создавали белки, содержащие искусственную аминокислоту, — специально для присоединения метки. Однако нет предела совершенству.
Как не навредить?
Отнюдь не всегда удается так приделать нужную метку, чтобы функции белка не изменились. А если метка их меняет, то изучение никак не удается провести в режиме реального времени, наблюдая живую клетку или организм. Порой метки и сами вступают в реакции с содержимым клетки. У систем, использующих аминокислоты как субстрат для присоединения метки, есть и принципиальное ограничение. Если манипуляции с белками можно проводить за счет модификации генов и клетка станет вырабатывать белок с искусственной аминокислотой, то с другими важнейшими молекулами жизни — жирами, полисахаридами, нуклеиновыми кислотами — этот подход не работает.
Вот тут и возникла идея взять вещества, которые принципиально не способны вступать в реакции, свойственные живой материи. Тогда они по определению не нарушат биологические процессы, не потеряются бездарно, соединившись с нецелевой молекулой. Очевидно, что таких веществ в идеале не должно быть в живой природе, это полностью искусственные вещества, продукт человеческой фантазии и умения. Именно потому, что такие вещества вступают в реакции, невозможные для биологических веществ, их и назвали биоортогональными.
Первый реагент
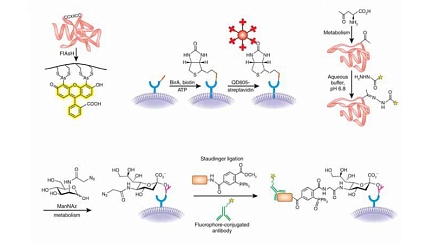
Пионерами на этом поле в 1998 году оказались Роджер Цянь (Roger Y. Tsien, по рождению Цянь Юнцзянь) и его коллеги из Калифорнийского университета в Сан-Диего. Он много сделал для внедрения в практику биологии зеленого флуоресцентного белка, за что получил Нобелевскую премию по химии за 2009 год. К сожалению, если этот белок присоединить как метку к какому-то исследуемому белку, функции последнего изменятся: слишком большая молекула у такой светящейся метки. Цянь с коллегами решили использовать маленькую светящуюся молекулу, которая ничего в живой клетке не испортит.
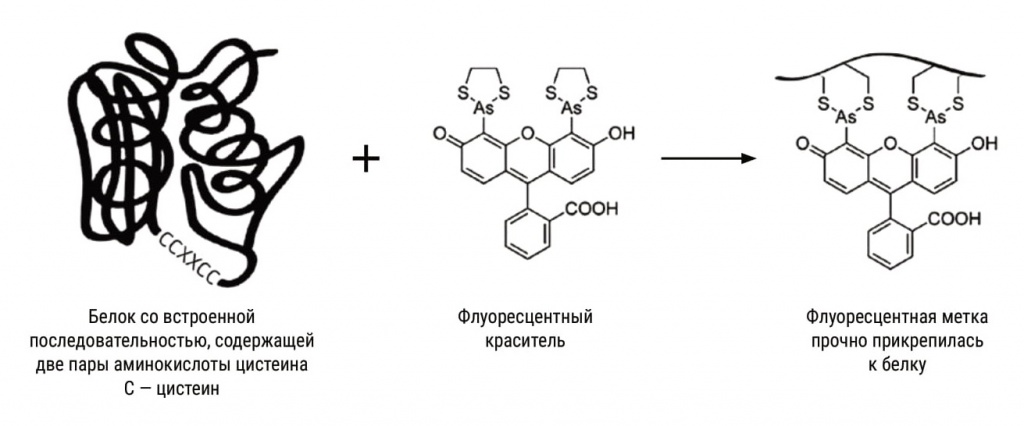
По их задумке, у этой молекулы должны, подобно рогам, торчать две группы, в которых к мышьяку привязаны по два атома серы. Эти группы станут присоединяться к двум парам молекул аминокислоты цистеина, у которой тоже есть содержащая серу тиоловая группа, а еще, чтобы совпали расстояния, между цистеинами надо поместить две какие-то аминокислоты. Получается, что в белок надо встроить фрагмент ССХХСС, где С — цистеин, а Х — другая аминокислота. Но это не все: требуется очень точно выдержать и расстояние между мышьяками, только тогда пойдет реакция присоединения метки именно к требуемому фрагменту изучаемого белка, а не куда-то еще. В 1998 году, перепробовав 14 подобных соединений мышьяка с флуорофором, Цянь с коллегами наконец нашли единственное, удовлетворяющее этому условию: 4’,5’-бис(1,3,2-дитиоарсолан-2-ил) флуоресцеин, или сокращенно FlAsH. Его молекула легко и точно присоединялась к тиоловым группам на поверхности модифицированного белка и начинала светиться.
Оба вещества отсутствуют в живой природе, а придуманная малая светящаяся молекула не будет вступать в реакции с живым веществом, поскольку у натурального белка на поверхности нет искусственной тиоловой зацепки (впоследствии выяснилось, что это не совсем так: есть в организме и свои белки с большим числом цистеинов). Светящаяся молекула легко проходит сквозь мембрану клетки, и действительно, синтезирующая модифицированный белок клетка светилась при добавлении реагента с меткой, показывая распределение изучаемого белка.
Получился прекрасный инструмент для наблюдения процессов в живой клетке, вполне себе биоортогональный. Правда, он работает не с натуральным, а со слегка отредактированным белком. То есть метод годится только для изучения белков и только в каких-то модельных условиях, в искусственно созданных организмах. В реальных организмах методом Цяня ничего осветить не удается.
 |
|
|
Листая старые страницы
Работа Цяня породила бум интереса к новому подходу: исследователи стали искать такие пары малых молекул, которые были бы способны точно и быстро находить друг друга в живом бульоне и реагировать только между собой. И при этом хотя бы одну молекулу из такой пары можно приделать к какой-нибудь молекуле биологического происхождения. Приделать другим концом, не задействованным в биоортогональной реакции.
Где их искать? Как оказалось — в старых книгах. Именно там Кэролин Бертоцци и отыскала реакцию Штаудингера, которую немецкий химик Герман Штаудингер обнаружил более века назад, в 1919 году. В реакции Штаудингера азид (соединение, имеющее цепочку из трех атомов азота) соединяется с фосфином (у него к атому фосфора присоединено три радикала). Оба этих соединения, во-первых, не вступают в реакции с биологическими молекулами, а во-вторых, отсутствуют в живой природе, это продукт искусственного синтеза в лаборатории. А еще они легко проходят сквозь клеточную мембрану. Все как надо для достижения биоортогональности.
Азид маленький, если его прикрепить к крупной биологической молекуле, он не сильно повлияет на ее электронные облака, на вес, не придаст ей реакционной способности, в общем, функции последней не будут нарушены. А вот если потом добавить препарат с фосфиновой меткой, то удастся эту биомолекулу пометить. Однако если азид сам собой с биологическими молекулами не взаимодействует, как же им метить молекулы в живой клетке?
Например — так. Бертоцци синтезировала сахарид, к которому присоединила азид. Этот сахарид добавила в питательную среду, где выращивала экспериментальные клетки. Те употребляли сахарид и использовали его при изготовлении своих гликопротеинов. Соответственно, азидная цель для фосфиновой метки оказывалась в биологических молекулах, и их можно было изучать.
Идея применить реакцию Штаудингера, а ее Бертоцци с коллегами предложили в 2000 году, сработала. С ее помощью удалось повесить флуоресцентные метки на многие важные биомолекулы и проследить за их поведением как в колбе, так и в клетках, и даже в целых живых организмах (к счастью для исследователей, некоторые из них, скажем мальки рыбы-зебры, прозрачны). Этот метод применили для анализа гликопротеинов и составления их номенклатуры, изучения ферментов, взаимодействия нуклеиновых кислот и мониторинга синтеза белков.
Медный клик
Однако совершенства достичь все же не удалось. Реакция Штаудингера идет медленно, и, чтобы получить осмысленный результат, надо использовать большие количества реактивов. А это может нарушить нормальную жизнь изучаемой клетки. Однако главное — невозможно следить за быстротекущими жизненными процессами. Да и фосфины оказались малоустойчивыми на воздухе.
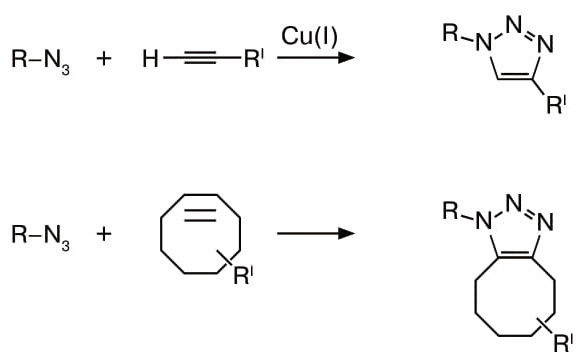
Проблему удалось решить с помощью еще одной старинной реакции, которую в 1893 году впервые провел американец Артур Михаэль. В ней азид реагирует не с фосфином, а с алкином, содержащим тройную связь между атомами углерода. Про реакцию забыли на долгие годы, пока в 1963-м идея не привлекла внимание немецкого химика Рольфа Хюсгена, и теперь реакция между азидом и алкином носит его имя. Реакция Хюсгена идет при нагреве, поэтому не так привлекательна. Однако в 2001 году, после того как Валерий Фокин открыл медно-аскорбиновый катализ азид-алкинового циклоприсоединения в водной среде при комнатной температуре, интерес резко вырос. Именно эта реакция и легла в основу клик-химии, за которую дали первую часть Нобелевской премии по химии 2022 года (см. «Химию и жизнь», 2022, 10).
Биологов эта идея привлекла, ведь удавалось заменить нестабильный фосфин реакции Штаудингера на прочный алкин реакции Хюсгена. Поскольку алкины также отсутствуют в живых системах, требование биоортогональности сохранилось. Более того, алкин столь же мал и стабилен в условиях живой клетки, как и азид. Поэтому можно обоих партнеров по будущей реакции использовать и как цель, прикрепленную к биомолекуле, и как метку, несущую какую-то функциональную молекулу или частицу. Главное же, что реакция идет в 25 раз быстрее!
Смущало только использование меди: ее большое количество в живом организме совершенно неуместно. Впрочем, преимущества перевесили, реакцию Хюсгена с медным катализатором стали использовать для биологических исследований. И сейчас в каталогах химических компаний есть немало таких систем для установки меток на биомолеулы.
Напряжение против меди
Однако медь все же яд, и было бы хорошо от нее избавиться, если речь идет об экспериментах в живых системах. Тут опять пригодились старинные фолианты. Там нашлось упоминание, что в 1961 году Георг Виттиг и Адольф Кребс из Института органической химии Гейдельбергского университета обнаружили, что если взять циклоалкин, у которого атомы углерода сомкнуты в цикл, где и находится присущая алкинам тройная связь, то он будет взрывным образом реагировать с азидом без всяких нагревов и катализаторов.
Причина в том, что карбоциклы крайне напряжены и потому неустойчивы. И чем больше напряжение, тем быстрее идет реакция. Простейший из устойчивых циклоалкинов — циклооктин с кольцом из восьми атомов углерода. Добавив к нему функциональные группы, которые перетягивают на себя электроны из цикла, Бертоцци с коллегами в 2007 году так усилили напряжение в кольце, что скорость реакции с азидом оказалась не меньше, чем у систем с линейными алкинами и медным катализатором.
Это оказалось новейшим и пока не превзойденным успехом в деле биоортогональных реакций. Считается, что циклоалкины не проявляют никакой ядовитости по отношению к живым существам: ими можно без ограничений метить биологические молекулы хоть в колбе, хоть в живых клетках, хоть в развивающихся эмбрионах или личинках многоклеточных существ. А благодаря скорости реакции, измеряемой минутами, удается следить за перемещениями меченых молекул в клетках в режиме реального времени. И такие опыты уже проводят, в частности — на развивающихся эмбрионах мыши и рыбы-зебры.
Рассуждая о перспективах биоортогональных реакций, Бертоцци отмечает следующее: «Мы ожидаем, что дальнейший прогресс будет достигнут не просто за счет оптимизации имеющихся инструментов, но и за счет открытия совершенно новых биоортогональных реакций. Как показало использование работ Штаудингера, Хюсгена, Виттига и Кребса, эти новые методы можно получить в результате изучения тайной химической литературы и переноса известных (если они забыты) реакций в совершенно иную среду, среду живых систем.
Мы считаем, что область прямого поиска совершенно новых биосовместимых реагентов, включая те, которые легко получить биосинтезом, остается малоисследованной и такой поиск принесет немало плодотворных открытий.
Для успеха химики и биологи должны тесно сотрудничать, чтобы исследования находили ответы на вопросы, соответствовали неудовлетворенным экспериментальным потребностям в биологии. Мы предполагаем, что задачу поиска новых биоортогональных химических соединений не следует понимать просто как создание инструментов для биологов, но как серьезный интеллектуальный вызов химикам. Они должны мыслить за пределами колбы с круглым дном, думать над надежными химическими реакциями, которые способны работать в живых системах и учить нас пониманию этих систем в течение грядущих десятилетий».
По мнению специалистов, поиск нужно вести в следующих направлениях. Это увеличение скорости реакций, желательно в тысячу или десять тысяч раз. Тогда, при сохранении эффективности, удастся снизить концентрации реагентов. Это уменьшение размеров молекул-реагентов, чтобы еще сильнее снизить их вмешательство в жизненные процессы с участием меченых биомолеул. Это и разработка взаимоортогональных реакций, то есть таких, участники которых не способны взаимодействовать не только с биологическим окружением, но и с участниками других пар. Тогда в живую систему удастся вводить несколько систем меток и сразу следить за какими-то параллельно идущими процессами. Видимо, Нобелевская премия 2022 года придаст немалый импульс таким поискам, как это было, например, в случае с исследованиями фуллеренов.
 |
|
|
Задачи биоортогональной химии
Биоортогональные реакции позволяют не только прицеплять светящиеся метки на биомолекулы и соответственно проводить диагностику или наблюдать за работой биологической машинерии. Главные достоинства таких реакций — высокая скорость, способность реагентов преодолевать клеточные мембраны, а также барьеры внутри организма вроде гематоэнцефалического барьера, невмешательство реагентов в биологические процессы. Ими можно воспользоваться и для получения лекарственных препаратов.
Важнейшее направление работы — синтез лекарств непосредственно в живой клетке. Предполагается, что такое лекарство состоит из двух неактивных компонентов, которые соединятся когда метка, несущая один компонент, реагирует с целью, прикрепленной к другому компоненту. После этого получившееся соединение обретает активность. Например, таким образом можно отправить избранный белок в систему утилизации отходов клетки. Этот же способ позволяет сделать самоингибитор для какого-то фермента, скажем, заблокировать деятельность протеазы ВИЧ, важнейшего компонента жизнедеятельности этого опасного вируса.
Есть и такое направление мысли, как активация препарата биоортогональной реакцией. Для нее строят конструкцию, в которой метка делает неактивным привязанный к ней препарат. Попав в ткань, куда заранее введен второй компонент реакции, метка его быстро находит, и происходит реакция, которая разрушает метку. При этом освободившаяся от ее опеки целебная молекула выполняет свою функцию. То есть препарат формируется только в ткани, подлежащей лечению.
Удастся ли перейти от идей к использованию таких реакций для лечения человека? Прямого ответ нет. Исследователи много надежд возлагают на моноклональные антитела с радиоактивными метками. Современная биотехнология умеет делать антитела, которые прецизионно присоединяются к выбранной биомолекуле, например рецептору на поверхности раковой клетки. К такому антителу можно приделать радиоактивную частицу, и тогда, теоретически, она пометит раковую ткань. Метку будет видно в томографе, либо же радиация испепелит переродившиеся клетки.
Однако антитела долго, в течение дней, путешествуют по организму. В результате к тому времени, как они соберутся в больной ткани, короткоживущий изотоп, используемый в диагностике, утратит свою активность, а долгоживущий облучит здоровые ткани. Все меняется, если антитело несет на себе один компонент биоортогональной реакции. Вполне можно подождать, пока все такие антитела не соберутся в больной ткани, а потом ввести в организм второй компонент реакции с пришитой радиоактивной частицей. Он быстро, за минуты, найдет цель и поразит ее.
Пока что таких препаратов нет, есть только данные доклинических испытаний. Но они обнадеживают, и есть шанс, что системы, которые с использованием биоортогональных реакций позволяют синтезировать лекарственные препараты из предшественников непосредственно в ткани, требующей лечения, когда-нибудь будут изобретены.
 |
|
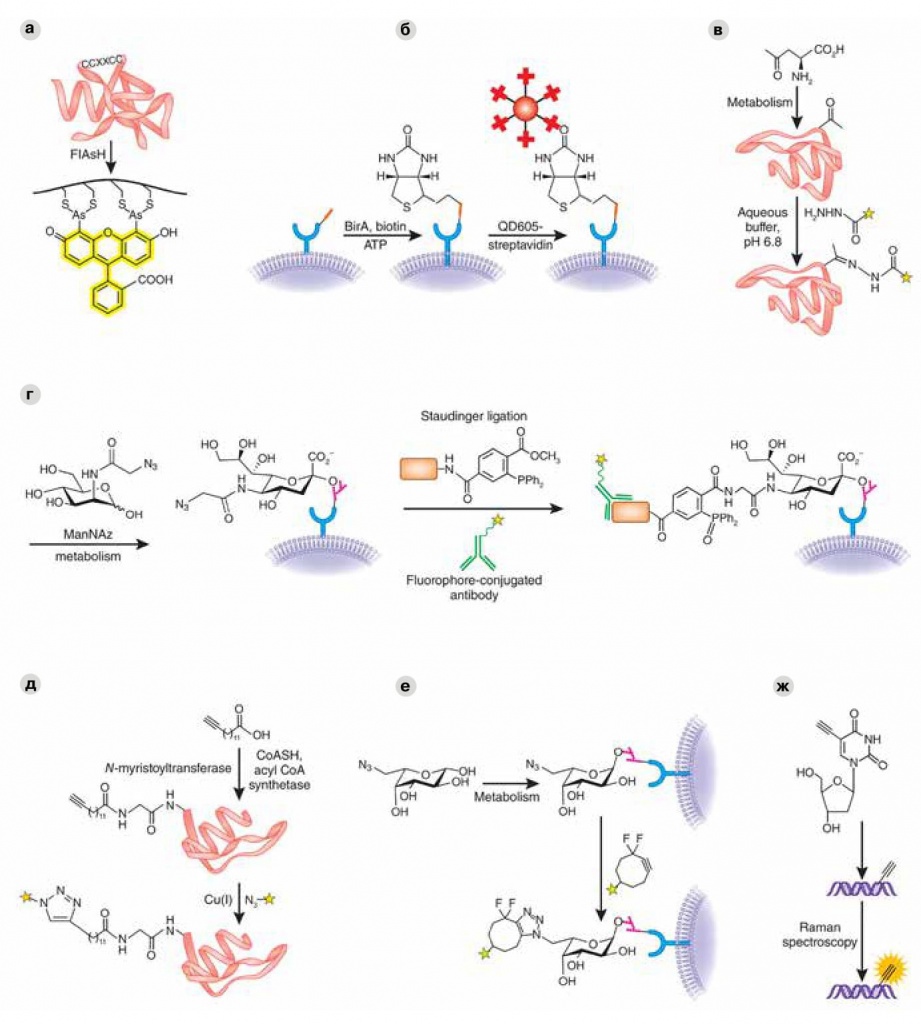
На рисунке — семь разных биоортогональных реакций. Всех их объединяет одна цель — прицепить к белку тем или иным способом светящуюся метку (флуоресцентную молекулу, светящуюся квантовую точку, антитело со светящейся меткой), чтобы потом можно было наблюдать за его жизнью в живой клетке. Рисунок взят из статьи Michael Boyce, Carolyn R Bertozzi в журнале «Nature Methods» (2011, 8, 638–642) |
