Не ждать милостей от эволюции
 |
|
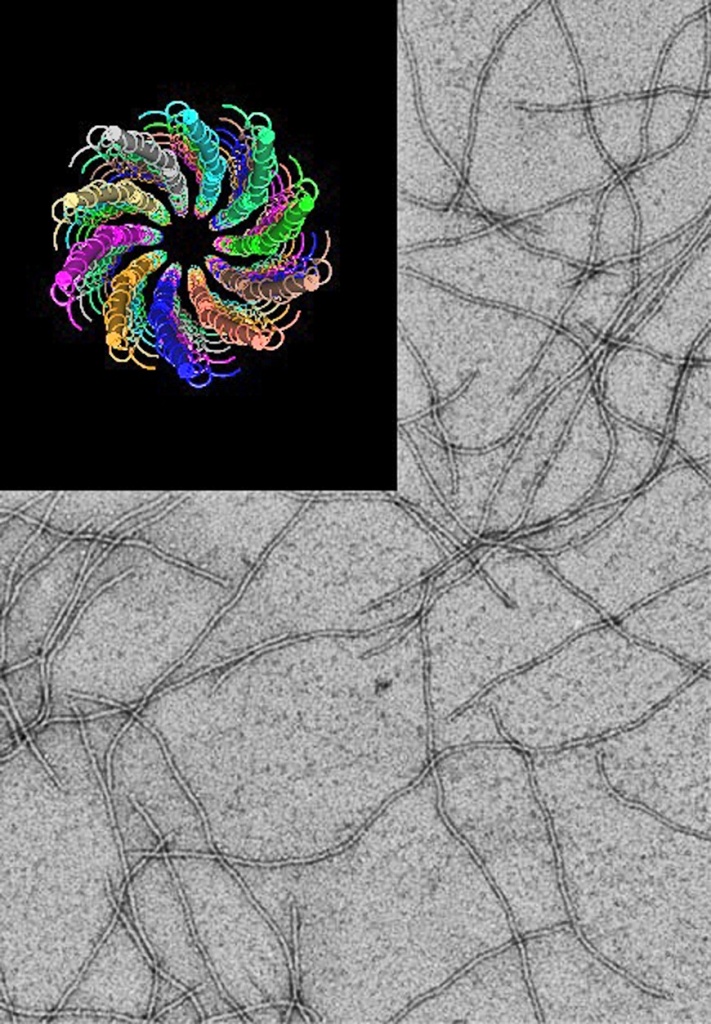
Нитевидный фаг fd — орудие фагового дисплея. Структура капсида (поперечный срез).
|
Человек, как и все обитатели планеты Земля, появился благодаря эволюции. А в конце ХХ века он сам научился ее использовать. И ладно бы для сотворения живых существ — для лучшего протекания химических реакций! В 2018 году химикам, которые первыми направили эволюцию белков в нужную сторону и получили молекулы, которые могли бы и не образоваться в ходе неспешной биологической эволюции, присуждена высшая научная награда современности. Лауреатами Нобелевской премии по химии 2018 года стали Фрэнсис Арнольд (Калифорнийский технологический институт, США), Джордж Смит (университет Миссури, США) и сэр Грегори Уинтер (Кембриджский университет, Великобритания). Белки-катализаторы — ферменты, созданные с помощью направленной эволюции, — сегодня участвуют в производстве возобновляемого биотоплива, синтезе лекарственных препаратов и решают множество других задач. Белки-антитела, полученные с помощью особого подхода под названием «фаговый дисплей», сражаются с аутоиммунными и онкологическими заболеваниями.
Одна из самых могущественных сил во Вселенной — эволюция. Благодаря ей за четыре миллиарда лет жизнь распространилась по всей Земле, и в любом ее уголке, от «черных курильщиков» — подводных гидротермальных источников — до полярных снегов, обитают живые организмы, приспособленные именно к таким условиям. Приспособленность обеспечивают постоянное появление случайных мутаций и естественный отбор, сохраняющий удачные варианты. Или, на молекулярном уровне, — появление белков, обеспечивающих наиболее эффективное взаимодействие растений и животных со средой их обитания. Десять тысяч лет человечество применяет искусственный отбор, выводя новые сорта растений и породы животных. Можно сказать, что уже с неолитической революции люди оптимизировали свойства ферментов и других функциональных белков, правда, большую часть времени они не знали, что занимаются селекцией и генетикой микроорганизмов, а просто варили пиво и пекли хлеб.
Для многих из нас естественный и искусственный отборы ассоциируются с биологией, но давайте посмотрим на них глазами химика. Существование жизни на Земле возможно благодаря тому, что эволюции удалось решить целый ряд сложных химических задач. Все живые организмы способны извлекать вещества и энергию из окружающей среды. Так, обитатели полярных широт могут противостоять низким температурам с помощью белков-антифризов (см. «Химию и жизнь», 2016, 12). Белки бактерий из горячих источников не денатурируют при температурах выше 90°С. Живущие в полосе прибоя моллюски прикрепляются к скалам с помощью белкового клея, отлично работающего в воде. Список белковых молекул с уникальными свойствами, появившихся благодаря естественному ходу биологической эволюции, можно продолжать бесконечно.
К концу ХХ века, когда биологи и химики уже были достаточно осведомлены о том, какими маршрутами протекает биологическая эволюция, возникла идея ускорить появление белков с желаемыми свойствами — перенести их эволюцию в лаборатории, где ее можно было бы подталкивать в нужном направлении.
Направляемая человеком эволюция ферментов (Фрэнсис Арнольд) или антител (Джордж Смит и сэр Грегори Уинтер) — многократно повторяющийся процесс, который включает определение строения белка, внесение изменений в его ген, экспрессию измененного белка и скрининг — отбор на нужные свойства среди разнообразных мутантов. Например, если этот белок — фермент, разлагающий некое вещество, вредное для бактерии, гены белка внедряют в бактериальные клетки, а вещество добавляют в среду, на которой бактерии растут. Очевидно, что самые лучшие ферменты синтезируют те бактерии, которые выжили. После этого все повторяется с отобранными белками и их генами до тех пор, пока в очередном раунде новый белок не продемонстрирует желаемый уровень ферментативной активности, специфичности или прочности связывания с антигеном.
Лучшее из того, что есть
Половина Нобелевской премии 2018 года присуждена профессору Калифорнийского технологического института Фрэнсис Арнольд за работы в области направленной эволюции ферментов. Однако история рукотворных биологических катализаторов началась за десятилетие до первой публикации Арнольд в этой области. В 1984 году Манфред Эйген (разделивший с Рональдом Норришем и Джорджем Портером Нобелевскую премию по химии 1967 года за изучение сверхбыстрых химических реакций) опубликовал теоретическую работу, в которой впервые предположил, каким образом можно будет осуществить направленную эволюцию ферментов («Pure and Applied Chemistry», 1984; doi: 10.1351/pac198456080967, полный текст). Заметим, что общими вопросами эволюции биомолекул Эйген интересовался и раньше, см., например, статью М. В. Волькенштейна в «Химии и жизни» (1974, 8). В статье 1984 года Эйген указывал, что оптимизация свойств ферментов будет интересной и сложной задачей, поскольку генотип и фенотип определяются различными молекулами. Он предполагал, что от больших библиотек ферментов и генов, отвечающих за их экспрессию, толку будет немного — в них трудно, если вообще возможно, найти ферменты, работающие эффективнее природных. Эйген предложил использовать небольшие библиотеки ферментов, формирующиеся за несколько последовательных поколений мутагенеза, и предсказал, что рано или поздно появится возможность создания «эволюционной машины», действующей методом пошагового приближения, которая и позволит получать ферменты с оптимизированной структурой и свойствами.
Девятью годами позже Фрэнсис Арнольд опубликовала первую экспериментальную работу, описывавшую успешную направленную эволюцию фермента в лаборатории (PNAS USA, 1993; doi: 10.1073/pnas.90.12.5618). Это был субтилизин Е — фермент класса гидролаз, катализирующий гидролиз белков и пептидов, а также сложных эфиров и амидов N-защищенных аминокислот. Фрэнсис Арнольд получила версию субтилизина, сохранявшую активность в денатурирующем окружении — в водных растворах, содержащих высокие концентрации диметилформамида (ДМФ). Через четыре этапа случайного мутагенеза с последующим определением каталитической активности мутантных белков в присутствии ДМФ появился фермент, активность которого в 60%-ном растворе ДМФ была в 256 раз выше, чем у природного субтилизина Е.
Так впервые удалось показать, что при улучшении природных ферментов проще полагаться на случайные мутации и тщательный отбор белков, свойства которых случайно же изменились в нужную сторону, нежели пытаться получать новые ферменты, контролируя каждый этап их синтеза. Внесение фактора случайности стало первым и наиболее важным шагом к получению модифицированных ферментов с требуемыми свойствами.
Следующий шаг сделал Виллем Штеммер, исследователь из Нидерландов (Штеммер скончался в 2013 году, иначе он бы тоже мог претендовать на часть премии). Он предложил использовать для эволюции ферментов стратегию рекомбинации ДНК, которую назвал ДНК-шафлингом, или перетасовкой ДНК («Nature», 1994; doi: 10.1038/370389a0). Ноу-хау Штеммера позволяло быстрее получать выгодные мутации, увеличивая размеры библиотеки за счет рекомбинации фрагментов функционально сходных генов, взятых у нескольких организмов. Штеммер с соавторами использовал перетасовки ДНК для увеличения активности фермента бета-лактамазы, который у бактерий отвечает за устойчивость к антибиотикам из группы бета-лактамов. Вскоре после публикации работы Штеммера метод начали использовать и в лаборатории Арнольд, и ко второй половине 1990-х годов она и Штеммер стали «законодателями мод» в этой области.
К концу прошлого века направленная эволюция ферментов значительно упростилась — получать библиотеки белков-катализаторов стало легче, поскольку манипуляции с ДНК становились все дешевле. Каталитическая активность ферментов значительно превосходила активность катализаторов, созданных в лабораториях; кроме того, к концу ХХ — началу XXI века в синтетической каталитической химии появилась тенденция к разработке методов синтеза веществ без катализаторов на основе переходных металлов. Поэтому работы Арнольд и ее последователей быстро приобретали практическое значение. Направленную эволюцию ферментов стали использовать не только для проведения уже известных реакций в экзотических условиях, но и для создания белков, способных катализировать химические реакции, не существующие в природе. Многие из таких реакций не просто протекают с большой скоростью и образованием минимального количества побочных продуктов, но и оказывают меньшее химическое давление на окружающую среду.
Так, одна из задач, которую нам придется решить рано или поздно, — производство заменителя ископаемого топлива, которое не наносило бы существенного вреда окружающей среде. Одно из возможных решений видится в получении жидких спиртов из короткоцепочечных и газообразных алканов, здесь самым перспективным кандидатом принято считать изобутанол. Его может производить рекомбинантная кишечная палочка Escherichia coli. Но в метаболическом пути, который закончится получением изобутанола, должны участвовать два фермента, которым необходим в качестве кофактора восстановленный никотинадениндинуклеотидфосфат (НАДФН), а обычные клетки E. coli вырабатывают восстановленный никотинадениндинуклеотид (НАДН), что понижает эффективность биосинтеза изобутанола. Арнольд с соавторами использовала направленную эволюцию, изменив ферменты таким образом, что они начали работать с НАДН, и в результате кишечные палочки стали производить изобутанол со 100%-ным выходом («Metabolic Engineering», 2011; doi: 10.1016/j.ymben.2011.02.004).
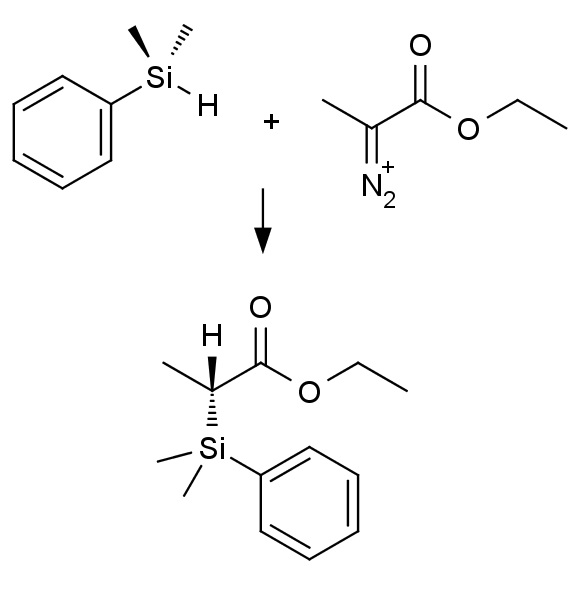
Еще одно применение ферментов, измененных с помощью направленной эволюции, — органический синтез. Так, связи «углерод—кремний» часто встречаются в продуктах и полупродуктах органического синтеза, но абсолютно нехарактерны для природных соединений — естественная эволюция так и не создала ни одного фермента, способного катализировать образование такой связи. Арнольд с соавторами обнаружили, что белки, содержащие гем, могут катализировать реакцию внедрения карбенов, также чуждую для живых организмов.
 |
|
Измененные в ходе направленной эволюции ферменты катализируют образование связи Si—C |
Карбены представляют собой активные производные двухвалентного углерода с общей формулой RRC: (два заместителя и два свободных электрона на атоме углерода). Карбены активно внедряются во многие связи «элемент—водород», но делают это крайне неразборчиво, образуя смесь продуктов присоединения. Поэтому биохимики из группы Арнольд искали белковый катализатор, который не только был бы способен ускорять внедрение карбена в связь Si—Р и образование связи Si—C, но и проводить реакцию избирательно, с образованием минимального количества побочных продуктов, а в идеале — единственного изомера.
После скрининга производительности было решено оптимизировать эффективность белка цитохрома, вырабатываемого бактерией Rhodothermus marinus. В ходе скрининга обнаружили и другие белки, которые образовывали связь Si—C с большей эффективностью, однако для этого цитохрома наблюдался 97%-ный энантиомерный избыток (преимущественное образование одного из оптических изомеров). Его направленная эволюция позволила получить фермент, каталитическая активность которого была в сорок раз выше, чем у исходного белка, а энантиомерный избыток реакции составлял 99% («Science», 2016; doi: 10.1126/science.aah6219).
Направленная эволюция позволила разработать эффективные белки-катализаторы и для получения связей «углерод—бор» («Nature», 2017; doi: 10.1038/nature24996), и для аминирования связи C—H с преимущественным образованием одного из оптических изомеров («Angew. Chem. Int. Ed.», 2014; doi: 10.1002/anie.201402809).
Даже это небольшое количество примеров показывает, что возможности направленной эволюции ферментов огромны. А впереди еще достаточно широкие перспективы — создание катализаторов для новых химических процессов, увеличение их эффективности, повышение специфичности к различным субстратам. Биотопливо вместо нефти, дешевый и безвредный органический синтез. Может быть, именно белковые катализаторы позволят человеку эволюционировать в приличного, безопасного для соседей обитателя Земли?
Антитело растет на фаге
Другая половина Нобелевской премии 2018 года тоже присуждена за направленную эволюцию белков, но уже не ферментов, а антител. Ключевую роль в эволюции этих биомолекул сыграл метод, получивший название «фаговый дисплей».
 |
|
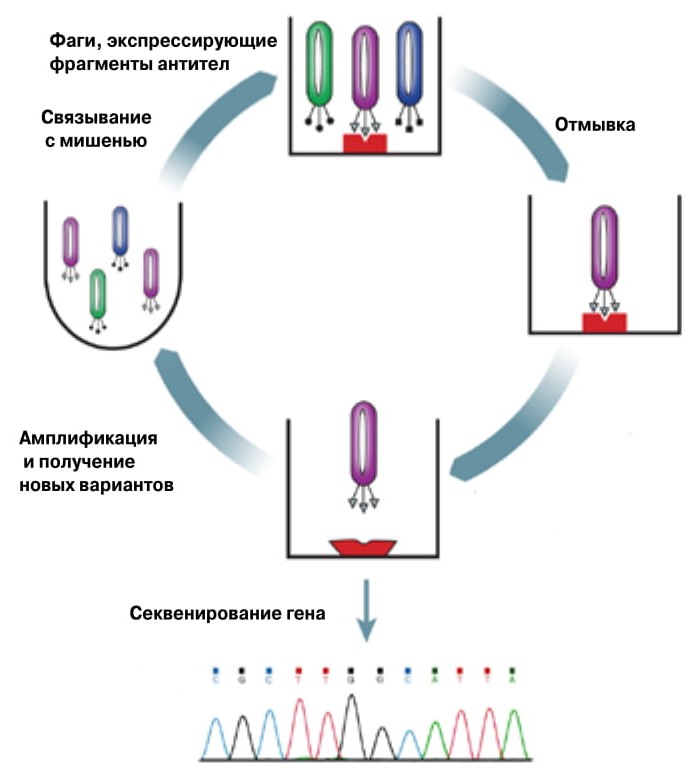
Фаговый дисплей: принцип метода |
Метод фагового дисплея разработал Джордж Смит («Science», 1985; doi: 10.1126/science.4001944). Фаги, или бактериофаги, — это вирусы бактерий. Генетический материал фага заключен в капсид — упаковку из белковых молекул. Белки, естественно, закодированы в геноме фага. И если в ген фагового белка вставить ген другого белка — того, что интересует экспериментатора, — при размножении фага этот белок появится на поверхности фаговых частиц. Можно сказать, что фаг отображает на себе нужный белок, отсюда и название метода. С таким белком удобно работать, например изучать его взаимодействия с другими биомолекулами. Используя связывание белка с рецепторами, легко проводить скрининг, а потом размножать те фаги, которые несут белки, отличающиеся наилучшим связыванием. Для размножения достаточно инфицировать фагами бактерии (обычно используют ту же кишечную палочку). А после размножения снова повторяется раунд селекции, и таким образом создается библиотека белков с нужными свойствами. Фаги здесь используются как простейшие конструкции, объединяющие генотип и фенотип: легко внести изменения в ген, проверить, как изменились свойства белка, и снова взяться за ген.
В своей основополагающей работе Смит вывел на поверхность фага фрагмент рестрикционной эндонуклеазы (фермента, который разрезает ДНК в определенном месте) из 57 аминокислотных остатков. Затем он провел однократную аффинную очистку антисывороткой к эндонуклеазе и показал, что фаг с эндонуклеазным фрагментом извлекается в тысячекратном избытке по сравнению с другими фагами. Повторение аффинной очистки позволяет добиться еще большего обогащения. Смит предположил, что с помощью антител к определенным белкам можно будет селективно выделять из библиотек фаги с этими белками.
В 1988 году Джордж Смит высказал еще одну идею: экспрессия на поверхности фагов большого количества пептидов со случайной структурой может быть полезна для поиска эпитопов — участков антигена, которые распознаются иммунной системой («Gene», 1988; doi: 10.1016/0378-1119(88)90495-7). Это не должно быть очень сложно, так как большая часть антител распознает небольшой линейный участок белка, состоящий из пяти или шести аминокислотных остатков.
Смит также предсказал, что фаговый дисплей пептидов может помочь разработке вакцин, если выводить на поверхность фага антигены — фрагменты белков возбудителя инфекции. Это предсказание стало теоретической основой исследований, в которых была обнаружена антигенная активность пептидов возбудителя малярии Plasmodium falciparum.
Основы метода фагового дисплея, разработанные в лаборатории Смита, благодаря их простоте были немедленно взяты на вооружение другими научными коллективами. В начале 1990-х годов практически одновременно появились десятки работ, описывающие экспрессию библиотек коротких пептидных последователей на нитевидном бактериофаге и подбор пептидов, связывающихся с определенными мишенями. Метод фагового дисплея пептидных библиотек весьма способствовал изучению связывания антител с эпитопами. А обратный процесс — фаговый дисплей антител и использование антигенов для селекции — стал важным шагом в разработке терапевтических антител.
В 1990 году третий нобелевский лауреат 2018 года сэр Грегори Уинтер сообщил о дисплее на нитевидном бактериофаге полностью функционального фрагмента антитела («Nature», 1990; doi: 10.1038/348552a0). Антитела, они же иммуноглобулины, — большие молекулы, состоящие из нескольких белковых цепей, двух легких (коротких) и двух тяжелых (длинных). Поэтому Уинтер с коллегами разместил на фаге лишь одноцепочечный вариабельный фрагмент — конструкцию, в которой вариабельная часть тяжелой цепи связана с легкой цепью с помощью гибкого полипептидного линкера. Именно вариабельные участки связывают антигены, и как раз за счет своей вариабельности они обеспечивают бесконечное разнообразие антител, соответствующее разнообразию антигенов.
В первой работе Уинтер и его коллеги разместили на фаге фрагменты антител мышей, иммунизированных лизоцимом из белка куриного яйца. Оказалось, что комплексы «антитело-фаг» связываются с куриным лизоцимом, однако не с человеческим и не с лизоцимом из яйца индейки — значит, фрагмент на фаге очень точно повторяет структуру природного антитела. Всего две последовательные аффинные очистки увеличили концентрацию фага с нужным фрагментом антитела в миллион раз.
Работа Уинтера, доказавшая эффективность применения фагового дисплея для подбора белковых фрагментов, прочно связывающихся с определенным антигеном, значительно упростила получение терапевтических антител, и это стало началом фармацевтической революции. Сам Уинтер определил несколько плодотворных направлений в этой области. Он предложил концепцию создания и скрининга больших библиотек антител, полученных случайным комбинированием участков генов, которые кодируют вариабельные участки длинных и коротких цепей. Еще одна его идея — создание и скрининг полностью синтетических антител.
В конце концов Уинтер показал, что можно использовать фаговый дисплей для направленной эволюции антител и создания терапевтических препаратов на их основе. Он создал огромную библиотеку фагов, несущих миллионы антител. Из этой библиотеки он выуживал антитела, которые прочно связывались с определенными белками, изменял эти антитела случайным образом и создавал вторую библиотеку, из нее отбирал антитела с еще большей прочностью связывания. В 1994 году такой подход позволил разработать антитела, которые специфично распознают клетки некоторых линий рака.
Отсюда было уже недалеко до важных практических применений. Уинтер с коллегами создал компанию по разработке и производству фармакологически активных антител. В 90-е годы компания вывела на рынок препарат, представляющий собой видоизмененное антитело человека — адалимумаб (он также известен под торговой маркой «Хумира»). Это антитело нейтрализует белок — фактор некроза опухоли TNF-альфа, отвечающий за воспалительные процессы при многих аутоиммунных заболеваниях. С 2002 года адалимумаб разрешен для лечения ревматоидного артрита, сейчас он также используется в терапии псориатического артрита и анкилозирующего спондилита.
К настоящему времени эволюция белковых антител и фаговый дисплей позволили создать антитела от рака, которые в ряде случаев успешно применялись даже для лечения метастазов, — это исторический прорыв в лечении онкологических заболеваний. С помощью направленной эволюции получены антитела, нейтрализующие токсин возбудителя сибирской язвы или замедляющие развитие волчанки. Клинические испытания проходят антитела, предназначенные для борьбы с болезнью Альцгеймера.
Важное преимущество антител, полученных с помощью направленной эволюции, состоит в том, что они связываются со своими мишенями в тысячи и миллионы раз прочнее, чем антитела, вырабатываемые организмом в результате иммунизации. Поэтому антитела, полученные при помощи фагового дисплея, пациент может самостоятельно вводить себе под кожу, в то время как менее эффективные антитела, полученные при иммунизации, необходимо вводить внутривенно под наблюдением врача.
Методы, разработанные нобелевскими лауреатами 2018 года, в настоящее время используют во всем мире для создания «зеленых» производств, получения новых материалов и лекарств. Фрэнсис Арнольд, Джордж Смит и Грегори Уинтер привнесли революционные методы в биологическую, синтетическую и медицинскую химию, их разработки активно применяются на практике, что, будем говорить откровенно, справедливо не для всех Нобелевских премий по химии последних лет. Вклад в прогресс человечества, упомянутый Альфредом Нобелем в завещании, налицо уже сейчас и, очевидно, будет расти.
 |
|
Слева направо: сэр Грегори Уинтер, Джордж Смит, Фрэнсис Арнольд
|
Эта статья доступна в печатном номере "Химии и жизни" (№ 11/2018) на с. 12 — 15.
