Изучать, не разрушая
105 лет физико-химическому анализу
Посвящается выдающемуся ученому Леониду Антоновичу Серафимову (1929—2018)
Физики всё понимают, но ничего не знают. Химики всё знают, но ничего не понимают. А физикохимики ничего не знают и ничего не понимают.
Народная мудрость
Слияние химии с физикой
Исторически химия развивалась как наука препаративная, то есть при химическом исследовании объект переставал существовать или, по крайней мере, терял свою форму в результате измельчения, сжигания, растворения, осаждения и других операций. При этом для химиков оставались недоступными малоустойчивые соединения, например те, которые могут существовать только в растворе, а также субстанции с переменным химическим составом. И альтернативы для химиков долго не возникало: изучать можно только то, что держишь в руках.
Вместе с тем их современники-физики могли изучать свои объекты, не разрушая их и не нарушая хода происходящих в них процессов. Постепенно и химики пришли к убеждению, что нужно перенять опыт коллег. Им предстояло подружиться с физиками, научиться пользоваться их методами, что означало появление физической химии как таковой. Необходимо было также слияние химии еще с одной наукой — геометрией: сложные, многокомпонентные системы требовали графического отражения, иногда довольно непростого.
Основателем физической химии, да и автором этого термина, считают академика М.В. Ломоносова, который настаивал на союзе химии с физикой и геометрией. Вот две цитаты: «Если бы химики не гнушались поучиться священным законам геометрии, то, несомненно, могли бы глубже проникнуть в тайники природы» (1741); «Легче распознать скрытую природу тел, если соединить физические истины с химическими» (1749). Однако это стало реальностью не ранее середины XIX века.
Рождение фаз
До наступления эпохи ФХА химики старались иметь дело только с индивидуальными химическими соединениями, которые отличались постоянством состава и свойства которых, вообще говоря, не зависели от способа получения. А такие важные объекты, как растворы, сплавы, стекла, шлаки и газовые смеси, постоянством состава не отличаются, поэтому химики долго их игнорировали. Изучение «химических индивидов» дало свои неоспоримые плоды: атомно-молекулярное учение Шарля Жерара и Станислао Канниццаро (1858), теорию строения органических соединений А.М.Бутлерова (1858—1864) и конечно же Периодический закон, сформулированный Д.И.Менделеевым в 1869 году.
Важную роль в развитии всей химии сыграл в начале XIX века спор двух выдающихся французских химиков Жозефа Пруста и Клода Бертолле, продолжавшийся семь лет, — спор о том, возможно ли существование химических соединений с непостоянным составом. Пруст был против, он говорил, что «природа никогда не производит вещества иначе как по весу и мере». Бертолле же не без оснований считал, что состав химических соединений может зависеть от условий, в которых происходит взаимодействие веществ, их образующих. И если в то время большинство ученых приняли сторону Пруста, то в настоящее время открытия Бертолле нашли всемирное признание, а соединения с непостоянным химическим составом, изучаемые методами физико-химического анализа, в его честь называют «бертоллидами».
Фундаментом современной физико-химической науки стало учение об обратимом химическом равновесии, сформированное на основе трудов Джозайи Гиббса, Якоба Вант-Гоффа, Хенрика Розебома, Анри Ле Шателье и других ученых XIX века. Понятие фазы — «гомогенной части системы, отделенной от остальных частей видимыми поверхностями раздела», — предложенное Гиббсом, а также сформированное им «правило фаз» стали ключевыми во всей физической химии. Однако датой рождения физико-химического анализа принято считать 1913 год, когда была опубликована работа Н.С.Курнакова и С.Ф.Жемчужного «Давление истечения и твердость пластических тел». Именно в ней впервые появился термин «физико-химический анализ», который вскоре стал общепринятым.
Авторы этой работы показали, что любое физическое свойство системы зависит от ее состава, а для изучения фазового состояния и обнаружения новых химических соединений можно использовать плотность, твердость, электропроводность, вязкость и другие физические свойства. Н.С.Курнаков определил новое направление науки как «геометрический метод исследования химических превращений». Он же сформулировал и два главных принципа физико-химического анализа. Это принцип непрерывности: «При непрерывном изменении состава системы (или другого фактора равновесия) непрерывно меняются ее свойства», и принцип соответствия: «Каждому химическому индивиду или фазе переменного состава в системе соответствует определенный геометрический образ на диаграмме». Диаграмма — это зависимость какого-то свойства системы от состава, температуры и давления.
Впрочем, в использовании диаграмм для описания фазовых превращений у Курнакова были два великих предшественника — Д.И.Менделеев, построивший в 1865 году по данным о плотности растворов диаграмму «спирт — вода», где явно видны три химических соединения, и Д.К.Чернов, в 1868 году — 150 лет тому назад! — определивший температуры фазовых переходов в системе «железо — углерод» (их до сих пор называют точками Чернова). Имя Курнакова тоже осталось в истории физической химии: точкой Курнакова названа температура перехода сплава в упорядоченное состояние. Кстати, есть еще точка Кюри (температура магнитного упорядочения) и точка Нееля (антиферромагнитного).
Вглядимся в диаграммы
 |
|
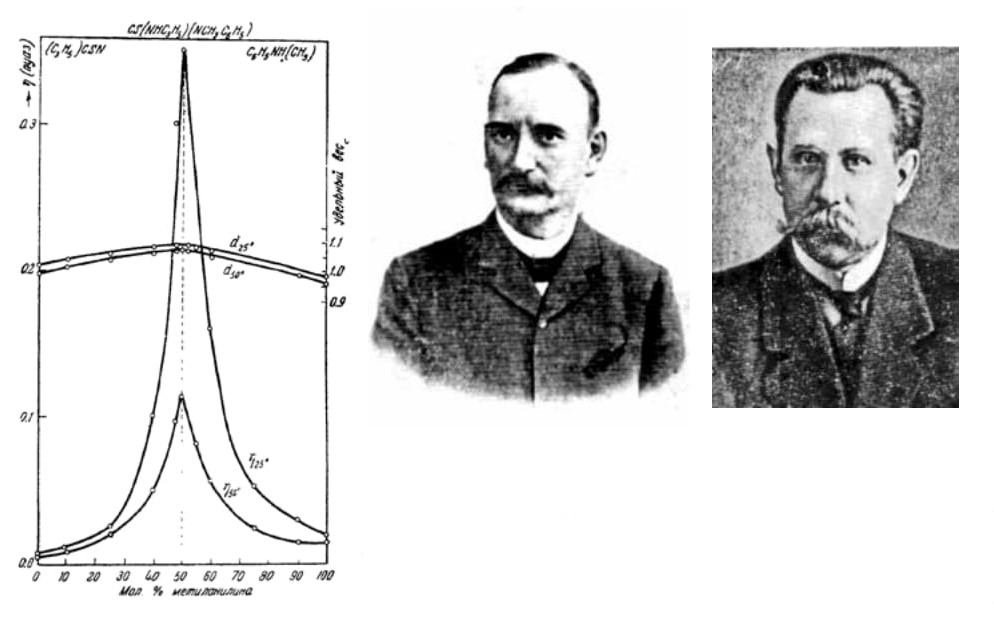
1. Изотермы плотности (d) и вязкости (η) в системе «метиланилин — аллиловое горчичное масло».
Авторы: Н.С. Курнаков (слева) и С.Ф. Жемчужный, 1913 год
|
На одном из графиков публикации Курнакова и Жемчужного хорошо видно (рис.1), как химическое взаимодействие между компонентами смеси проявляется в пикообразном возрастании вязкости при их мольном соотношении 1:1. Плотность смеси для этого состава также имеет максимум, но не настолько ярко выраженный.
Проведя измерения для разных составов и температур, можно получить набор точек, после соединения которых получается диаграмма фазовых превращений.
 |
|
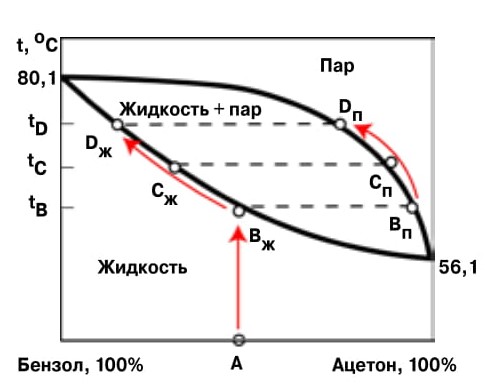
2. Диаграмма кипения смеси «бензол — ацетон» — пример наиболее простого кипения смеси двух компонентов. При нагреве до температуры tB(точка «В») смесь ацетона и бензола состава А начинает кипеть, образуя пар состава Впар, обогащенный легколетучим компонентом — ацетоном. При удалении дистиллята смесь обогащается бензолом, из-за чего температура ее кипения повышается до tD. По линиям Вж—Сж—Dж» и «Впар—Спар—Dпар на диаграмме кипения можно оценить равновесные составы жидкости и пара в каждый момент процесса дистилляции и управлять его ходом |
Ее размерность соответствует числу компонентов. В простейшем и самом частом случае их два (рис. 2). Работать с такой плоской диаграммой легко, надо только понимать, что линии — это места превращения одной фазы в другую, а в каждой точке максимальное число степеней свободы (число параметров, значения которых способно изменяться) может быть больше числа компонентов только на два — это и есть правило фаз Гиббса. Когда давление в двухкомпонентной системе зафиксировано — одна степень свободы истрачена. Если в равновесии находятся три фазы — из жидкости выпадают кристаллы обоих компонентов, тогда все степени свободы истрачены: пока процесс не закончится, температура не может меняться. Так на диаграмме появляются горизонтальные линии: места трехфазных равновесий. Геометрическое изображение смеси двух компонентов — дело несложное, для этого достаточно отрезка, концы которого соответствуют чистым компонентам, а промежуточные точки их смесям. Если на отрезке состава поставить точку, соответствующую химическому составу смеси, то отрезок будет разбит на два плеча; соотношение их длин даст соотношение количества компонентов в смеси состава, соответствующей этой точке. По аналогии со взвешиванием грузов на разноплечих весах этот прием носит красивое название «правило рычага».
 |
|
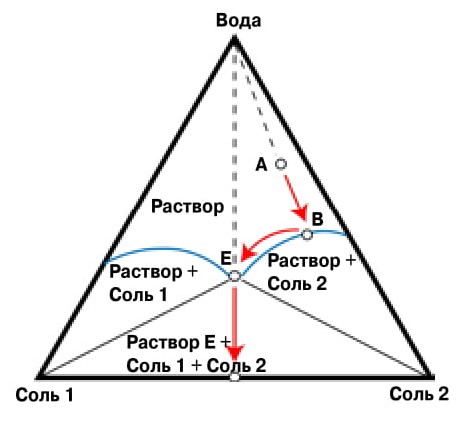
3. Типичная диаграмма кристаллизации трехкомпонентной системы «соль 1 — соль 2 — вода».
Изменение концентрации компонентов при упаривании раствора солей показано стрелками. От точки В до точки Е в твердую фазу выпадают кристаллы «соли 2», а после точки Е, называемой эвтоникой, выпадает уже смесь солей в постоянном соотношении друг с другом, находясь в равновесии с эвтоническим раствором состава Е. Анализ диаграммы позволяет определить условия выделения компонентов в чистом виде
|
Многокомпонентные смеси требуют более сложного графического представления. Например, трехкомпонентным нужен треугольник, вершины которого будут соответствовать чистым компонентам, ребра — трем бинарным смесям, а центр — смеси, где всех трех компонентов поровну (рис. 3).
Этот треугольник составов носит имя физикохимиков Гиббса и Розебома. Для описания смеси из четырех компонентов необходима трехмерная фигура — тетраэдр состава. А геометрический образ пятикомпонентной системы требует фигуры с пятью равноудаленными вершинами; в наше трехмерное пространство она уже не вписывается — такая фигура четырехмерна. Как видим, сложность геометрического представления смеси веществ в ФХА с каждым новым компонентом катастрофически возрастает.
Знаменитые кипения и расслоения
Метод ФХА работает и с металлическими, и с солевыми, и с органическими системами; каждый из этих типов имеет свои особенности, при их построении используют различные инструментальные методы. Тем удивительнее, когда мы видим общие закономерности и очень схожие геометрические объекты на диаграммах состояния легированной стали, минералов в горных породах, растворов и расплавов солей, сжиженных газов и сложных смесей продуктов органического синтеза. Давайте вспомним и рассмотрим некоторые диаграммы состояния, которые чем то интересны и заслуживают внимания.
Наиболее важна для развития всей современной техники система «железо — углерод». Можно сказать, что с ее исследования началась история научного материаловедения. (Подробнее об этой важнейшей из систем рассказано в № 3 «Химии и жизни» за 2016 год.) Подобные диаграммы, а они построены для огромного числа сочетаний металлов друг с другом и со многими неметаллами, — азбука для материаловеда; глядя на них, разрабатывают новые сплавы и режимы их обработки. В них можно найти столько интересного, что нет смысла начинать разговор об этом — обо всем не расскажешь.
 |
|
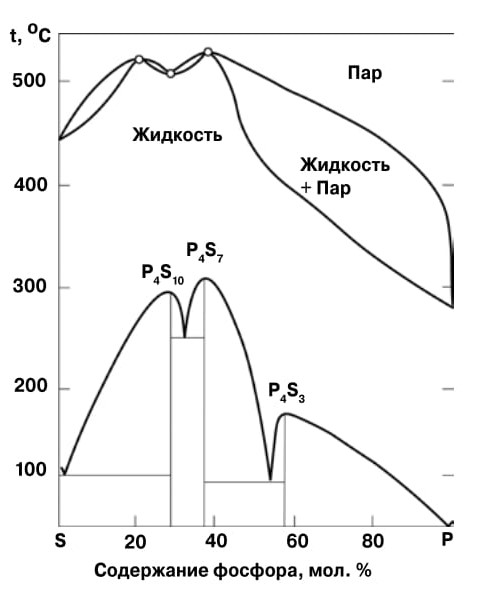
4. В системе «сера — фосфор» есть три азеотропные точки: две смеси имеют повышенную, а одна — пониженную температуру кипения |
Посмотрим лучше на необычное кипение смесей веществ. Многие знают, что даже при многократной перегонке спиртосодержащих водных растворов не удается получить этиловый спирт с концентрацией более 95,6% по массе. Из диаграммы ясно, почему так получается, — температура кипения этого состава (78,15оС) ниже, чем у каждого из компонентов, его составляющих, вот он и испаряется первым. Составы, соответствующие максимуму или (намного чаще) минимуму температуры кипения на фазовой диаграмме, называют азеотропными смесями. Такие смеси невозможно разделить на компоненты с помощью перегонки, поэтому их принимали даже за индивидуальные химические соединения, но это вступало в противоречие с тем, что состав азеотропных смесей зависит от давления.
До конца XIX века системы с азеотропами считались редкостью, немецкий физикохимик, нобелевский лауреат Вильгельм Оствальд называл их «исключительными растворами». Потом оказалось, что азеотропы не так уж и редки: их наблюдают почти в половине исследованных систем. А в 1966 году сообщили, что на диаграмме кипения смеси бензола и перфторбензола проявляют себя сразу два азеотропа: с максимумом и минимумом температур кипения. Вскоре были открыты и другие системы с двумя азеотропами, на сегодня их известно не менее двенадцати. Но есть совершенно удивительная, не имеющая аналогов диаграмма кипения, имеющая сразу три азеотропа! Их наблюдают при изучении смесей серы и фосфора (рис. 4).
Интересно, что два из трех азеотропов в этой системе близки по составу к известным соединениям фосфора и серы, которые при плавлении дают единую жидкую фазу. Видимо, присутствие этих соединений в расплаве и служит причиной такой уникальной аномалии.
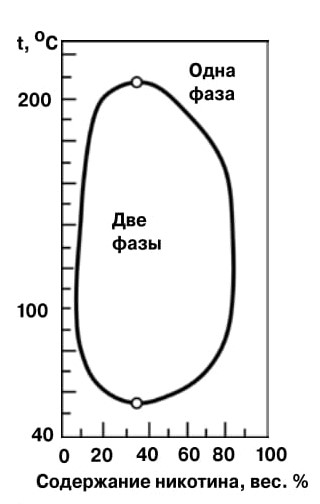 |
|
5. В системе «никотин — вода» область расслоения имеет и верхнюю, и нижнюю температуры расслаивания
|
Встречаются и необычные расслоения. Мы привыкли к тому, что жидкости, не смешивающиеся с водой (например, бензин или подсолнечное масло), имеют довольно отличную от нее природу. Но оказалось, что на основе водорастворимых органических, в частности полимерных соединений можно получить растворы, состоящие наполовину и более из воды, которые тем не менее не смешиваются с водными растворами солей. К примеру, полиэтиленгликоль хорошо растворяется в воде, однако при добавлении в раствор сульфатов, фосфатов, роданидов он выделяется в виде отдельной фазы, которая с раствором соли не смешивается. А водные растворы антипирина и нафталин-2-сульфокислоты при смешении выделяют вторую фазу в виде небольшой капли, в которой заодно концентрируется и большинство тяжелых металлов, если они есть в таком растворе. Неудивительно, что это явление используют для разделения и концентрирования различных компонентов, причем без применения токсичных органических растворителей. Интересное разделение двух жидкостей на два слоя наблюдается в системе «никотин — вода» (рис. 5): они полностью смешиваются при очень низких или очень высоких температурах, а при средних температурах дают две несмешивающиеся жидких фазы.
Когда-то на занятия по физической химии в МИТХТ им. М.В.Ломоносова лекторы для демонстрации расслоений приносили цилиндр, в котором большое количество несмешивающихся жидкостей находились в равновесии друг с другом. Многое с тех пор уже позабылось, но попробую представить подобный набор. Это могут быть гексан, водные растворы полиэтиленгликоля и сульфата аммония, фторорганика, силиконовое масло, нитробензол, сплав галлия с индием, ртуть. Возможно, еще одну фазу, не смешивающуюся со всеми названными жидкостями, сформирует нитрил янтарной кислоты (достоверно известно, что он не смешивается ни с гексаном, ни с водой, при этом он сильно отличается и от других названных выше жидкостей). Таким образом, можно получить восемь, а то и девять жидкостей, не смешивающихся друг с другом. Что-то подобное создают в своей практике и бармены, приготавливая коктейли из разноцветных слоев напитков, с той разницей, что все эти слои у них не представляют самостоятельных фаз и после перемешивания не всегда расслаиваются обратно.
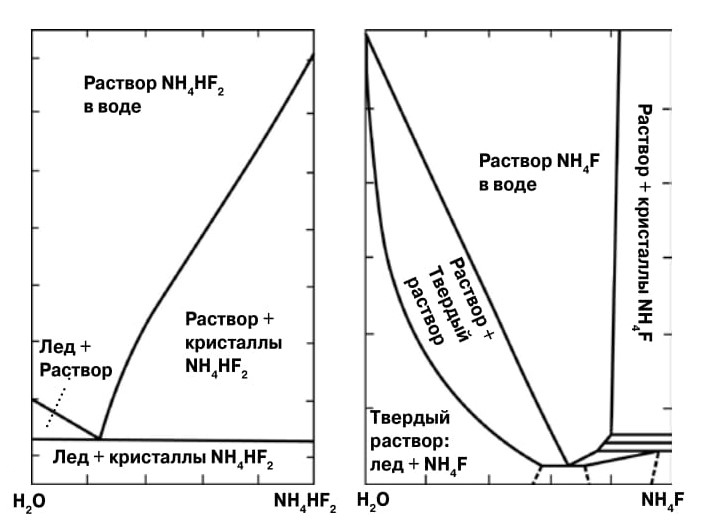 |
|
6. Из бифторида аммония нельзя получить «соленый лед», то есть твердый раствор соли в водяном льду, а из фторида аммония — можно |
А проявляются ли какие-то физико-химические сюрпризы при кристаллизации? Да, есть и такие. Возьмем одну из самых распространенных на планете систем «лед — соль», например замерзшую морскую воду. Лед и кристаллы солей (включая кристаллогидраты) имеют настолько различную структуру, что кристаллизуются только в виде самостоятельных твердых фаз: соленый лед невозможен, морская вода замерзает как смесь кристаллов чистого льда и соли. Это удачно иллюстрирует диаграмма кристаллизации бифторида аммония, приведенная на рисунке 6 слева, она похожа на многие другие диаграммы кристаллизации. И только в одном исключительном случае кристаллическая соль и водяной лед могут образовывать твердые растворы. Это система «фторид аммония — вода». Обнаружившие это явление ученые не поверили, что такое возможно, но при проверке другими исследователями факт подтвердился. Теперь «соленый лед» стал одним из курьезов физико-химического анализа.
Прекрасный флюид
Для того чтобы найти очередной сюрприз ФХА, необязательно рассматривать многокомпонентные системы. На диаграмме состояния даже единственного вещества можно выделить область, в которой оно приобретает удивительные, противоречивые свойства. Речь идет о сверхкритических флюидах, СКФ. Многим известно, что по мере нагревания смеси жидкости с собственным паром в замкнутом объеме свойства обеих фаз постепенно приближаются друг к другу до тех пор, пока не сравняются окончательно. Точка на диаграмме состояния, в которой это происходит, называется критической. Ей соответствуют критические значения температуры и давления, превышение которых приводит к образованию чего-то среднего: не жидкости и не газа. Это и есть сверхкритический флюид.
От газа СКФ отличается высокой плотностью и способностью растворять различные вещества. От жидкости — высокой подвижностью, низкой вязкостью, способностью быстро диффундировать внутрь материалов, а также сильной зависимостью плотности от давления. Это делает СКФ замечательным растворителем. Например, обычный углекислый газ в состоянии СКФ (то есть при температуре выше 31,1оС и давлении выше 72,8 атм) по растворяющей способности похож на гексан, и его широко применяют для сверхкритической флюидной экстракции. Кофеин из зерен кофе с его помощью экстрагируется практически мгновенно, зерна даже не приходится дробить. Выделение экстрагированных компонентов не составляет труда, достаточно просто сбросить давление, перевести СКФ в состояние газа, который ничего растворять в себе не способен.
С помощью сверхкритического пропана (t > 96,7оС, P > 41,9 атм) можно извлечь ценные компоненты из нефтепродуктов, а затем, ступенчато сбрасывая давление, уменьшать растворяющую способность СКФ и последовательно выделять из него отдельные фракции битумов, парафинов, смол и высококачественных масел. СКФ позволяет успешно окрашивать материалы и волокна, разделять полимеры по фракциям, определять следовые концентрации некоторых веществ, при этом не требуется применение дорогостоящих и токсичных растворителей. Удивительным набором ценных свойств обладает вода в сверхкритическом состоянии. Подробнее о применении СКФ в науке и технике рассказано в № 2 «Химии и жизни» за 2000 год.
Многомерная физикохимия
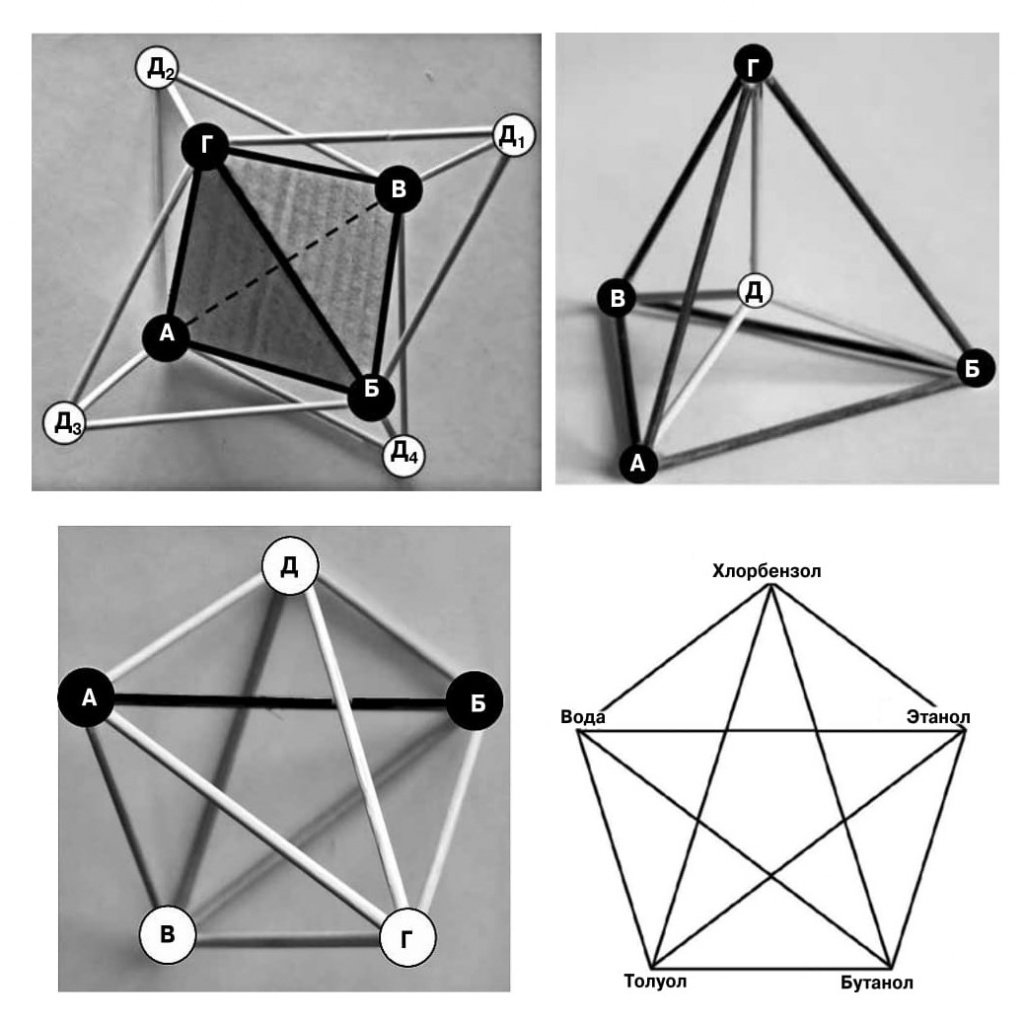 |
|
7. Развертка пентатопа, две его проекции и пример использования для представления состава пятикомпонентой смеси. У развертки вершины Д1, Д2, Д3 и Д4 должны при сворачивании фигуры сформировать вершину Д. У проекций темным цветом выделены элементы, находящиеся в нашем пространстве, светлые элементы спроецированы из четырехмерного пространства на наше трехмерное |
Специалисты по ФХА в своей научной практике частенько заглядывают в четырехмерное пространство и параллельные миры. Необходимость в этом возникает при анализе пятикомпонентных смесей, для графического представления которых требуется четырехмерный аналог тетраэдра, пентатоп. Он состоит из пяти тетраэдров, соединенных своими вершинами, что невозможно представить в трехмерном пространстве. Конечно, исследователи, занимающиеся физико-химическим анализом, стараются максимально упростить модели и не выходить за пределы плоскости листа бумаги. Для этого сложные многомерные диаграммы представляют в виде проекций и сечений. Автору статьи довелось провести самостоятельный геометрический анализ пентатопа, изготовить трехмерные модели его развертки, семи его проекций, исследовать их сечения (более подробно тема рассмотрена в журнале «Наука и жизнь», № 5 за 2018 год). На рисунке показана развертка пентатопа, наиболее простая из его проекций на наше трехмерное пространство, и приведен пример использования пентатопа для представления пятикомпонентной смеси органических растворителей, образующейся после локальной очистки сточных вод в производстве кремнийорганических эмалей, «этанол — бутанол — толуол — хлорбензол — вода».
Автор статьи учился, а потом многие годы работал на кафедре химии и технологии редких и рассеянных элементов им. К.А.Большакова в МИТХТ им. М.В.Ломоносова (сейчас входит в состав Российского технологического университета). Эта кафедра традиционно активно пользуется приемами физико-химического анализа в своей научно-исследовательской практике, однако ее сотрудникам удается ограничиться треугольными диаграммами. А вот для кафедры химии и технологии основного органического синтеза того же университета тетраэдры и пентатопы — «рабочие лошадки», без которых обойтись никак нельзя. Профессор Л.А.Серафимов, корифей кафедры ХТООС, и один из основателей целого раздела ФХА, который носит название «термодинамико-топологического анализа». Его цель — именно разделение сложных многокомпонентных смесей, в первую очередь для органического синтеза. Без построения диаграммы состава и определения по ним направлений, по которым изменяются составы смесей при их перегонке, тут не обойтись.
Геометрическое исследование топологии многокомпонентной системы часто позволяет избежать трудоемких расчетов и длительных экспериментов и дает возможность изящно составить оптимальный алгоритм разделения сложных смесей. Топологический анализ помогает также правильно составить алгоритм численных экспериментов, задать компьютеру программу вычислений, смоделировать формулами то, что не удается постичь пространственным воображением. При этом химикам зачастую приходится погружаться не только в четырехмерный мир, но и в пространства большей размерности.
Замечание о преемственности
Наверняка у читателей возник вопрос: почему в ней такое внимание уделяется не очень-то круглой дате — 105-летию? Причина, как это ни банально, заключается в том, что все научное российское, а тем более зарубежное сообщество пять лет назад обошло вниманием столетний юбилей физико-химического анализа. И автору захотелось хоть с опозданием, но воздать должное основателям этого научного направления, напомнить о тех ученых, которым все мы многим обязаны. Тревожный звонок — современные российские ученые заняты поисками грантов и финансирования, им уже не до того, чтобы отслеживать важные даты в истории науки. Мы отрываемся от своих научных корней, и это очень печально. Терять преемственность не следует.
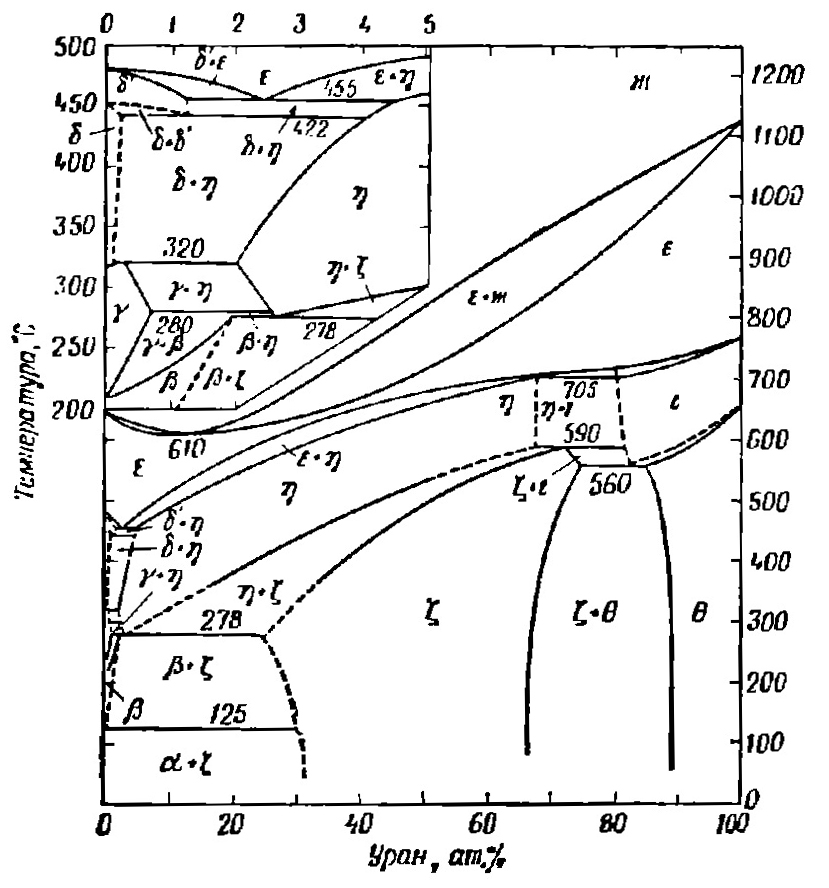 |
|
Диаграмма состояния системы «уран — плутоний» |
Автор статьи работает в АО «ВНИИНМ», в базовой организации ГК «Росатом» в области материаловедения ядерных и специальных неядерных материалов для атомной энергетики и ядерного оборонного комплекса. Это предприятие носит имя выдающегося ученого-материаловеда академика А.А.Бочвара, дважды Героя Социалистического Труда, лауреата Ленинской премии, который внес существенный вклад в развитие атомной науки и техники, а в частности, и физико-химического анализа. Он создал теорию эвтектической кристаллизации, заложил основы структурной теории жаропрочности сплавов, предложил прием для оценки температуры начала рекристаллизации металлов, который так и называется — «правило Бочвара». Он открыл и исследовал явление сверхпластичности сплавов. Под его научным руководством впервые в СССР получен металлический плутоний, разработаны плутониевые сплавы для изделий специального назначения и технология изготовления первого советского ядерного заряда. Вот, например, как выглядит сложнейшая диаграмма состояния «уран — плутоний», которую построили на этом предприятии в рамках «Атомного проекта» под руководством самого академика А.А. Бочвара.
Эта статья доступна в печатном номере "Химии и жизни" (№ 8/2018) на с. 30 — 34.
