У оганессона нет орбиталей?
 |
|
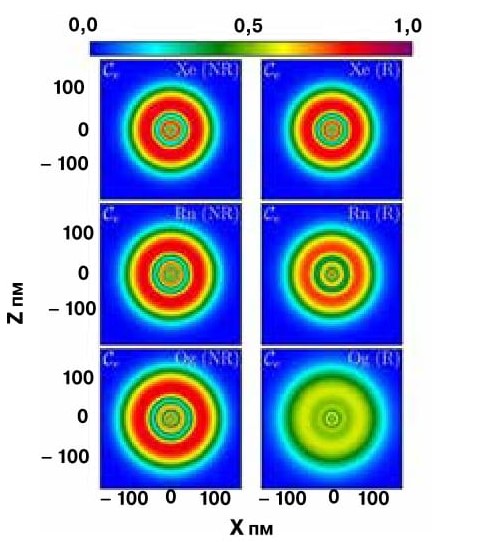
Смоделированная локализация электронов без релятивистских поправок (слева) и с учетом релятивистских поправок (справа) в атомах ксенона, радона и оганессона. Согласно расчетам, в оганессоне электроны не распределены по орбиталям, а образуют более или менее равномерно распределенное облако. |
Элемент № 118, оганессон, назван в честь Юрия Цолаковича Оганесяна, научного руководителя Лаборатории ядерных реакций им. Г.Н.Флерова ОИЯИ в Дубне. Это второй человек после Глена Сиборга, именем которого еще при его жизни назвали химический элемент. Суффикс «он» в названии оганессона объясняется его положением в Периодической системе — формально его можно считать самым тяжелым инертным газом. Именно формально: получено достаточно данных в пользу того, что характер заполнения электронной оболочки сверхтяжелых элементов совершенно не таков, как у легких. Дело в том, что из-за большого заряда тяжелых атомных ядер электроны в сверхтяжелых элементах разгоняются до такой скорости, при которой пренебрегать теорией относительности уже нельзя. Конечно же время жизни оганессона слишком мало, и определить экспериментально, будет ли элемент № 118 проявлять свойства инертного газа, невозможно. Тем не менее исследователи из Новой Зеландии и США провели квантово-химические расчеты, результаты которых позволяют считать оганессон уникальным атомом.
Любой школьник (иногда и школьный учитель химии) скажет, что оганессон обладает электронной оболочкой инертного газа, а значит, строение его внешнего слоя можно записать как 7s27p6. Тем не менее, химики-теоретики Петер Швердтфегер , Пол Жерабек (Университет Мэсси, Новая Зеландия), Бастиан Шутрумпф и Витольд Назаревич (Университет Мичигана) предсказывают, что распределение электронов, вращающихся вокруг столь большого ядра, в большей степени теряет свою оболочечную структуру, размываясь в «электронный газ».
Некоторые искусственные радиоактивные трансфермиевые элементы химики получили в количествах, достаточных для химических экспериментов. Элементы разделили с помощью хроматографии и определили валентные состояния для отдельно взятых атомов. Например, оказалось, что свойства резерфордия и дубния (элементы № 104 и № 105) отличаются от тех, которые можно было бы спрогнозировать по их положению в Периодической системе, а вот для элемента № 106 (сиборгия) никаких отклонений от предсказаний, сделанных с помощью Периодического закона, не было («Journal of Nuclear and Radiochemical Sciences», 2002, 3, 113—120; doi: 10.14494/jnrs2000.3.113). Отклонения вызваны изменением энергий электронов, развивающих околосветовые скорости под воздействием ядра со значительным положительным зарядом, говоря проще — релятивистских эффектов.
Исследователи отмечают, что для оганессона проявление релятивистских эффектов очень существенно — они обусловливают так называемое спин-орбитальное сочетание, то есть взаимосвязь спинового состояния электрона и характеристик его перемещения по орбиталям. При значительном спин-орбитальном сочетании заселенность электронов по уровням со строго определенными энергетическими характеристиками размывается, и электроны, находящиеся около ядра, распределяются практически равномерно, образуя облако электронного газа, или Ферми-газа.
Эффект размывания электронных оболочек постепенно увеличивается вместе с ростом заряда ядра. Согласно расчетам, оганессон существенно отличается от инертных газов, расположенных в той же группе Периодической системы. Состояние электронов в его атоме должно быть очень близким к предельной их делокализации — Ферми-газу. В таком «размазанном» состоянии электроны легко поляризуются, а значит, атомы оганессона будут связываться друг с другом прочными вандерваальсовыми взаимодействиями, и, наиболее вероятно, при комнатной температуре это будет не газ, а твердое вещество. Кроме того, коль скоро внешняя оболочка оганессона — не устойчивый октет, элемент № 118 будет гораздо реакционноспособнее по сравнению с его соседями — инертными газами.
.
