Вместо крови
Человеческая
Кровь, или жидкая ткань, на долю которой в теле человека приходится 7-8%, или, в среднем, – пять литров, выполняет важнейшую работу – переносит кислород, насыщая им клетки. Потерять много крови – это все равно что перекрыть кислород организму. Конечно, у крови есть и другие важные функции. Однако для нас сейчас интересна именно газотранспортная.
Переливание крови при операциях и тяжелых травмах происходит ежедневно в каждой клинике мира, поэтому потребность в крови велика. Эту потребность мы покрываем за счет донорской крови, а ее сейчас «много, но мало». То есть ее столько, что можно перевозить цистернами, но постоянно не хватает!
По данным благотворительного фонда «Подари жизнь», каждый день тысячам пациентов российских клиник не хватает крови. Специалисты считают, что в любой стране должно быть не менее 40 доноров на тысячу жителей (точнее, 40 кроводач в год на 1000 жителей), чтобы обеспечить медицинские нужды. Сейчас в Европе на тысячу человек приходится в среднем 25–27 доноров, в США и Канаде – 35-40, в России – 14. Теоретически донорами могут быть 10–15% населения, но в реальности людей, сдающих кровь, в десять раз меньше.
Конечно, цельную кровь уже лет пятьдесят как переливают в исключительно редких случаях. Оно и опасно, кстати. Не буду рассказывать об истории, часто трагической, переливания крови, начиная с открытия Гарвеем в 1616 году кругов кровообращения и вплоть до сегодняшнего расцвета трансфузиологии. Укажу только, что именно сейчас применяют. Во-первых – клеточные элементы (сами клетки крови): эритроцитарную, тромбоцитарную и лейкоцитарную массу. А во-вторых – препараты крови, получаемые из плазмы. Они подразделяются на препараты комплексного действия (сама цельная плазма, бета-глобулины и альбумин), гемостатические (криопреципитат, протромбиновый комплекс, фибриноген, тромбин, и антигемофильный протеин) и иммунологически активные (этих вообще великое множество, в основном происходят из гамма-глобулинов). Например, в ЦАХАЛе – армии обороны Израиля, имеющей наиболее интенсивный боевой опыт за последние 50 лет, – вообще отказались от применения донорской крови в полевых условиях. В качестве кровезаменителя они используют лиофилизированную плазму крови, при необходимости растворяя ее в дистиллированной воде за две-три минуты прямо на местах боевых действий – кислородная емкость цельной крови довольно избыточная, и в норме ее можно безбоязненно «разбавлять» плазмозамещающими растворами процентов на сорок.
Помимо того, что донорской крови постоянно не хватает, с ней вообще работать неудобно и опасно. Она частенько может быть источником гемотрансмиссивных инфекций. Это более дюжины вирусов (включая ВИЧ, гепатит В, С и Е, герпес человека 8-го типа и т. п.), десятки бактерий и паразитических простейших (возбудители силифиса, малярии, лейшманиоза, болезни Чагаса, сальмонеллеза и др.) И конечно же – прионы (губчатая энцефалопатия). От них форменные элементы крови и не отчистишь особо. А от прионов и вирусов даже препараты крови не обезопасишь.
Уже в течение первых десяти суток хранения способность крови к транспорту кислорода заметно уменьшается из-за химических процессов, происходящих в этой жидкой ткани. В общем, хранить эритроцитарную массу более 42 дней нельзя даже при использовании самых современных гемоконсервантов. Кстати, недостаток доноров в мире связан, главным образом, именно с ВИЧ и гепатитами.
Однако кровь или ее аналоги на самом деле нужны не только некоторым категориям пациентов. С недавних пор на нее поглядывают еще и биотехнологи, потому что без подходящих переносчиков кислорода чахнут биотехнологические производства и исследования в области тканевой инженерии. По сути дела, тканевая инженерия именно из-за этого исчерпала потенциал своего развития. Вот почему исследователи во всем мире активно разрабатывают заменители крови, которые могут на время взять на себя работу по доставке кислорода в клетки. Занимаются этим многие десятки лет, за которые создано масса претендентов на роль газотранспортных кровезаменителей. Их можно в целом разделить на два типа: условно называемые «гемоглобиновые» – на основе производных дыхательных пигментов (гемоглобинов человека, животных и внеклеточных дыхательных пигментов некоторых беспозвоночных) и условно называемые перфторуглеродные (на основе эмульсии перфторуглеродов).
Казалось бы, теперь врачи и ученые могут спать спокойно? Ан нет! Чтобы убедиться в этом, давайте познакомимся с исследованиями и препаратами в области заменителей крови с газотранспортной функцией.
Перфторуглеродная
Начну, пожалуй, именно с перфторуглеродных кровезаменителей, чтобы скорее с ними разделаться, ибо попросту не представляю себе перспектив их развития для получения полноценного кровезаменителя. Хотя сами они, конечно, штуки замечательные. У меня у самого уже скоро лет десять как в морозильном ларе хранится 100-миллилитровый флакон «Перфторана» – срок годности давно кончился, а выбросить рука не поднимается.
Итак, к перфторуглеродам (или фторуглеродам) относятся углеводороды, в которых все атомы водорода замещены на атомы фтора. Низшие фторуглероды – бесцветные газы или жидкости, не растворяются в воде. Высшие и особенно полициклические фторуглероды обладают аномально высокой способностью растворять газы: в частности, кислород и углекислый газ. В отличие от гемоглобина, они не образуют с кислородом химических соединений, а растворяют газы согласно закону Генри. Но как их ввести в кровь, если они не растворимы в воде? Приходится делать из них тонкодисперсные эмульсии с помощью поверхностно-активных веществ в качестве эмульгатора. Частицы такой эмульсии, введенные внутривенно, быстро (в течение 4–12 часов) удаляются из сосудистого русла тканевыми макрофагами, но могут накапливаться (причем некоторые – очень надолго, порой на недели и месяцы) в печени, селезенке, легких, поджелудочной и щитовидной железе, частично удаляясь через дыхательные пути.
В силу химической инертности перфторуглеродные эмульсии считают относительно безопасными для введения в некоторых количествах в кровь. К слову сказать, большинство побочных эффектов приписываются как раз эмульгаторам, обеспечивающим субмикронный размер эмульсионных частиц. Однако экономить на них нельзя: чем крупнее частицы перфторуглеродов, тем легче они сливаются, образуя мицеллы, способные закупоривать микрососудистое русло. А перфторуглеродная эмболия ничуть не лучше воздушной или жировой.
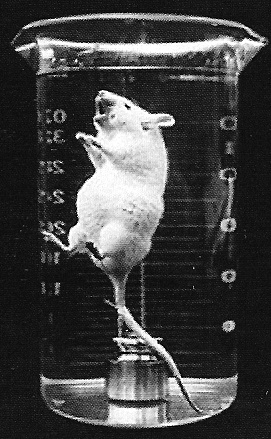
Трудно установить кому первому в мире пришла идея использовать фторуглеродные эмульсии как газотранспортные кровезаменители. Интенсивное их изучение для этих целей началось почти одновременно в конце 60—70-х годов ХХ столетия в разных странах. Первые попытки применить перфторуглероды в роли кровезаменителей связаны с экспериментами Л. Кларка и Ф. Голлана. Отчет об этих экспериментах вышел в журнале «Science» 24 июня 1966 года (https://www.ncbi.nlm.nih.gov/pubmed/5938414). Они показали, что мышь, погруженная в перфторорганическую среду FX-80, может дышать и не погибает. (Для тех, кто понимает, FX-80 – это перфлюоробутилперфлюоротетрагидрофуран). Но вот уже у организмов размером с кошку наступают проблемы с удалением углекислоты (на минуточку, в крови она отнюдь не в газовой форме, а в виде карбонатов и гидрокарбонатов, и потому чудесные перфторуглеродные свойства по растворению углекислого газа нам здесь пригодиться практически не могут). Так что особо не надейтесь на всякие там жидкостные дыхательные смеси для сверхглубоководных ныряний и полетов с ускорениями 50-70 g.
Впервые перфторуглеродный кровезаменитель на основе 20%-ной эмульсии перфторбутиламина был создан профессором Р. Гейером в середине 1960-х годов. К сожалению, препарат содержал избыток токсичных недофторированных аминов и свободных фторид-анионов, а потому был непригоден для медицины. С тех пор все исследователи сосредоточились на очистке перфторуглеродов от остаточных продуктов синтеза и стабилизации эмульсий.
У перфторуглеродов отдача кислорода тканям больше, чем у гемоглобина. Это связано с маленьким размером частиц эмульсии – всего 0,03–0,15 мкм, а размеры эритроцитов (клеток крови, содержащих гемоглобин и переносящих кислород) – в 100 раз больше. В результате контактная поверхность перфторуглеродной эмульсии в среднем оказывается на порядок больше, чем у эритроцитарной массы того же объема. Кроме того, в перфторуглеродном растворе количество растворенного кислорода находится в линейной зависимости от его концентрации в легочных альвеолах, в отличие от криволинейной (S-образной) зависимости в случае с гемоглобином.
Перфторуглероды выполняют самые разные работы при попадании в организм: улучшают газообмен и метаболизм в тканях, переносят кислород, стабилизируют мембраны клеток, улучшают кровоток и периферическую микроциркуляцию, восстанавливают центральную гемодинамику, обладают отчетливым кардиопротекторным действием, сорбционными и диуретическими свойствами. Они повышают активность дофаминергической и серотонинергической антистрессорных систем, благодаря чему нормализуется общее периферическое сосудистое сопротивление. Иными словами, у них много достоинств. Не удивительно, что их пытались применять еще и в трансплантологии.
Сама трансплантологическая тема – весьма интересная (по крайней мере, для меня), так что давайте немножко отвлечемся. Правда, тут гораздо больше использовали гемоглобиновые кровезаменители, о которых основной рассказ впереди.
Итак, первые попытки кратковременной перфузии изолированных органов при обычной температуре, без охлаждения, предпринимал еще Шарль Броун-Секар (1858 г.), знаменитый французский медик, вошедший в историю медицины как родоначальник гормонотерапии. В 1935 году французский хирург и биолог А. Каррель (еще и Нобелевский лауреат, сосудистый шов изобрел) в соавторстве с С. Линдбергом сообщили, что смогли довольно долго (в случае щитовидной железы – до 20 дней) поддерживать жизнедеятельность изолированных органов, взятых у кур и кошек (яичник, надпочечник, щитовидная железа, селезенка, сердце и почка). Но дальше дело почему-то не пошло. Заявленные Каррелем и Линдбергом результаты, по сути дела, не повторены до сих пор.
В общем, из-за технических сложностей (а на самом деле – из-за махровейшего научного консерватизма) в трансплантологии повсеместно стали использовать бесперфузионную холодовую консервация органов (это когда орган заполняется холодным раствором, близким по составу к внутриклеточной жидкости, и хранится при околонулевых температурах). Только в 2000-х годах постепенно начали развивать методы холодовой перфузии (почки, печень), а с 1994 года кратковременное (несколько часов) сочетание перфузии при физиологической температуре и вентиляции изолированных легких позволило заметно улучшить ближайшие результаты трансплантации.
Как правило, в состав перфузата добавляли гемоглобиновые кровезаменители, переносящие кислород. В любом орган случае после изъятия испытывает кислородную недостаточность, что может быть чревато острым отторжением или ускорит хроническое отторжение трансплантата. Для попытки борьбы с этим недавно был разработан компонент для растворов консервации органов HEMO2life®, созданный на основе внеклеточного дыхательного пигмента морских полихет М101, о котором будет рассказано ниже. Да и пора возвращаться к основной канве повествования, а то что-то мы совсем уже в сторону ушли.
Итак, перфторуглеродные кровезаменители можно условно разделить на три поколения, хотя ни второго, ни третьего поколения пока нет, да и не особо предвидится.
Представители первого поколения – «Флюозол» и «Перфторан». «Флюосол-ДА-20», или «Флюозол» создали в Японии еще в 1979 году. Он представляет собой смесь перфтордекалина и перфтортрипропиламина (70:30) с использованием (3,9%) смеси плуроника F-68 (неионное ПАВ), фосфолипидов яичного желтка и глицерина в качестве эмульгаторов. Минусы – совершенно недостаточная кислородная емкость, угнетение лейкоцитов и активация системы комплемента (каскадной системы из нескольких десятков протеолитических ферментов, компонента врожденного и приобретенного иммунитета). Состав хранили в виде трех отдельных растворов, которые перед применением размораживали, смешивали и оксигенировали, что очень неудобно, особенно в экстренных случаях. Препарат признали эффективным и относительно безопасным, а FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) одобрило его к медицинскому применению. На рынке он появился в 1989 году. Аналогичный препарат вскоре создали в Китае под названием «Эмульсия II», и с тех пор он пропал в безвестности.
Здесь надо уточнить, что «Флюозол» только улучшал доставку кислорода, но его способностей было совершенно недостаточно, чтобы стать полноценным газопереносчиком. Так что FDA его одобрило только для сугубо локального использования – при внутрисосудистой коронарной ангиопластике (это такая хирургическая манипуляция, выполняемая для расширения суженных сосудов сердца, раздувая их катетерами с надувными баллонами). При ней как раз имела место локальная ишемия миокарда – грубо говоря, баллон раздувается и ток крови останавливается. Но потом появились так называемые «аутоперфузионные катетеры» (это когда баллон раздувается, а ток крови полностью не прекращается) – ишемии при их применении больше не возникало, и, соответственно, показаний к применению «Флюозола» не осталось. И году в 1994-м препарат по-тихому изъяли из продажи.
В нашей же стране исследования по созданию кровезаменителей на основе перфторуглеродных эмульсий тоже начались в 1970-х годах в Ленинградском Центральном НИИ гематологии и переливания крови (ЛНИИГПК) и в Центральном ордена Ленина Институте гематологии и переливания крови (ЦОЛИПК), Москва. Это был «Перфукол» (тщились скопировать «Флюозол»), который не прошел клинических испытаний и в 1985 году уступил место «Перфторану» – разработке Института теоретической и экспериментальной биофизики АН СССР (ИТЭБ) в Пущине. А точнее, конкретно профессора Ф. Белоярцева, вдохновителя и главного разработчика «Перфторана». Этот первый отечественный газоранспортный кровезаменитель был скомпонован на основе смеси перфтордекалина и перфторметилциклогексилпиперидина, стабилизированной в виде эмульсии проксанолом. Потом был срыв испытаний по причине «выявленных нарушений регламента и фальсификаций материалов по испытаниям», доведение до самоубийства профессора Белоярцева за «расхищения казенного спирта», наказание невиновных и награждение непричастных… А потом грянула Перестройка, и только в феврале 1996 года эмульсия «Перфторан», выпускаемая теперь научно-производственной фирмой «Перфторан», зарегистрирована в РФ и разрешена для медицинского применения и промышленного выпуска.
От всех остальных современных ему аналогов, кстати, он отличается меньшим размером эмульсионных частиц. Вообще растворимость кислорода в перфторуглеродах составляет до 40-50 объемных процентов, но «Перфторан» – это 10%-ная эмульсия, и емкость по кислороду у него получается почти в три раза меньше, чем у цельной крови. И потому полноценно заменить кровь он не способен. Почти та же история, что и с «Флюозолом».
 |
|
Мышь, погруженная в перфторан, способный переносить кислород, может дышать |
В случае большой кровопотери «Перфторан» содействует газообмену между оставшимися эритроцитами и тканями. У эритроцитов кислородная емкость избыточна, при прохождении по капиллярам они чаще всего отдают не больше 20-30% накопленного кислорода. «Перфторан» увеличивает массоперенос кислорода в системе эритроциты–плазма–ткани. Эмульсионные частицы, окутывая эритроциты, в несколько раз увеличивают поверхность газообмена. В результате даже малые дозы «Перфторана» (1–10 мл/кг) могут давать значительный клинический эффект.
Перфтоуглеродные кровезаменители первого поколения отнюдь не идеальны – у них малая стабильность, технические трудности в подготовке к клиническому применению и такие побочные эффекты, как аллергические, иммунологические и анафилактоидные реакции. Впрочем, этими пороками в той или иной степени страдают все газотранспортные кровезаменители. Что перфторуглеродные, что гемоглобиновые. И потому перед использованием требуют премедикации – введения пациенту глюкокортикостероидов, антигистаминных препаратов, солей кальция. А то и кардиотонические средства наготове держат.
Кроме того, компоненты перфторуглеродных кровезаменителей могут задерживаться в тканях в течение продолжительного времени – попросту растворяются в липидах и там и остаются. Например, в случае «Перфторана» – если перфтордекалин выводится быстро, за один–три дня (в основном – через легкие, с выдыхаемым воздухом), то вот перфторметилциклогексилпиперидин можно найти в организме аж в течение 18-23-х месяцев.
Второе поколение перфторуглеродных кровезаменителей представляет препарат Oxygent (Alliance Pharmaceutical Corporation, Сан-Диего), созданный в начале 2000-х годов. Это эмульсия перфтороктилбромида (C8F17Br), или перфлуброна (более известного в качестве контрастного агента для магнитнорезонансной томографии), в котором в качестве эмульгатора используют фосфолипиды яичного желтка. Препарат стабилен в обычных условиях, не боится стерилизации и замораживания. У этого перфторуглерода, по сравнению с родственниками, самая высокая растворимость кислорода, он очень быстро выводится из организма (потому-то его и используют в качестве контраста для МРТ). К сожалению, в 2007 году третья стадия его клинических испытаний с участием больших групп пациентов была отложена из-за большого количества инсультов.
Также в начале 2000 годов компания HemaGen/PFC создала кровезаменитель Oxyfluor на основе перфтордихлороктана, стабилизированного лецитином и сафлоровым маслом (оно интересно тем, что хранится в течение года при комнатной температуре). Исследования на людях показали, что этот препарат, подобно Oxygent’у, склонен вызывать тромбоцитопению (снижение количества тромбоцитов) и гриппоподобный синдром. Видимо – из-за использования лецитина в качестве стабилизатора. Вторая стадия клинических исследований на пациентах хирургического профиля прошла удачно, но компания почему-то решила применять Oxyfluor исключительно в качестве средства для удаления нежелательных микропузырьков, образующихся в системах циркуляции крови при вспомогательном кровообращении. В модельных системах сердечно-легочного шунтирования Oxyfluor действительно оказался вполне эффективен для очистки крови от микропузырьков. Однако компания вскоре по каким-то причинам разорилась, и Oxyfluor больше не разрабатывается.
Препаратов третьего поколения мы пока не получили. Все имеющиеся прототипы в лучшем случае проходят стадию доклинических исследований. Судя по научным публикациям, основное внимание обращено на перфторуглероды, эмульгированные фосфолилидами, но используются также и линейные углеводородные/фторуглеродные молекулы со смешанными свойствами, придающие эмульсиям стабильность за счет связей углеводородным концом с жирными цепями фосфолипидной пленки, а фторированным концом – с перфторуглеродами. Потенциально это может позволить создавать концентрированные (до 90 объемных процентов) эмульсии со средним диаметром частиц 0,22 мкм, стабильные до 6 месяцев при 40°С. Отсутствие токсичности новых эмульсий вроде бы продемонстрировано на культуре эндотелиальных клеток человека и в экспериментах по консервированию органов животных. Но это все по большей части мечты.
К слову сказать, «Флюозол» – до сих пор единственный из перфторуглеродных кровезаменителей, бывший допущенным к медицинскому применению FDA. Скоро тридцать лет уже пройдет...
 |
|
Гемоглобин человека состоит из четырех закрученных белковых цепей, в каждой из которых присутствует гем. Гемоглобин, находящийся в клетках крови, эритроцитах, способен обратимо связываться с кислородом, тем самым обеспечивая его перенос в ткани |
Гемоглобиновая
Для начала напомню читателям о том, что такое гемоглобин. Это сложный внутриклеточный железосодержащий белок класса хромопротеинов, содержащий гем – особую пигментную группу, включающую атом двухвалентного железа, которая способна обратимо связываться с кислородом (а также некоторыми другими газами, которые нам тут совершенно не нужны), обеспечивая его перенос в ткани. Громадный вклад в исследование гемоглобина внёс английский биохимик Макс Фердинанд Перуц, получивший как раз за это в 1962 году Нобелевскую премию.
Гемоглобин – это тетрамер, то есть состоит из четырёх субъединиц – четырех полипептидных цепей. Последние обозначают как α1, α2, β1 и β2. Все субъединицы соединены друг с другом водородными связями по принципу изологического тетраэдра. Всего на тетрамер приходится четыре гема, по одному на каждую субъединицу. Молекулярная масса человеческого гемоглобина – около 66,8 кДа, находится он в эритроцитах, клетках крови.
Главная функция гемоглобина – переносить кислород. В капиллярах лёгких человека в условиях избытка кислорода последний соединяется с гемоглобином. Эритроциты с гемоглобином, нагруженным кислородом, доставляются к органам и тканям, где кислород высвобождается. Кроме того, гемоглобин способен связывать в тканях небольшое количество углекислого газа и освобождать его в лёгких. Впрочем, на фоне работы находящейся тут же, в эритроцитах, карбоангидразы, катализирующей взаимопереход углекислого газа в карбонатион, это малосущественно.
Тут как раз стоит пояснить, что такое сродство к кислороду. Высокое сродство – это когда гемоглобин любит кислород присоединять и не любит отдавать, что для наших целей не очень хорошо. У гемоглобина оно выше, чем у цельной крови. Правда, в чрезмерно низком сродстве к кислороду тоже ничего хорошего, тогда он начинает настолько хорошо его отдавать, что аж плохо присоединять.
Потому-то и получается, что в отличие от перфторуглеродов интимные взаимоотношения гемоглобина с кислородом намного более витиеватые – никакого там закона Генри и тому подобного. Кривая диссоциации – S-образная. В принципе, это эволюционное приспособление – четвертичная структура позволяет регулировать присоединение и отщепление кислорода, придает гемоглобину кооперативность. У дезоксигемоглобина (это когда кислорода нет) сродство к кислороду весьма низкое, и для начала реакции необходимо достаточное парциальное давление кислорода (что возможно, например, в альвеолах лёгких). Изменения в одной из четырех субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается. То же самое и с отдачей кислорода. Чем больше степень насыщения оксигемоглобина (когда кислород есть) кислородом, тем легче он его отдает.
В начале прошлого века ученые выяснили, что гемоглобин способен сохранять свою структуру и функции вне эритроцита. Хотя впоследствии оказалось, что это не совсем так – свободный гемоглобин имеет гораздо большее сродство к кислороду, чем эритроцитарный. В эритроцитах его понижает так называемый аллостерический регулятор оксигенации 2,3-дифосфоглицерол (пролазит между субъединицами, чуть меняя их конформацию, и понижает).
Тогда-то и родилась идея использовать в качестве кровезаменителя свободный гемоглобин. В 1916 году в Бостоне первые попытки переливания предпринял Уили Селлардс, а впоследствии – американский гистолог и патофизиолог Джордж Майнот, лауреат Нобелевской премии 1934 года: 33 пациентам ввели небольшие объемы раствора свободного гемоглобина.
Однако последующие попытки были безуспешными, поскольку порождали множественные побочные эффекты, в первую очередь – повышенное давление и сильное замедление пульса. Как выяснилось, свободный (внеэритроцитарный) гемоглобин гораздо более охотно, чем с кислородом, связывается с молекулами оксида азота (NO) – тут ситуация примерно как с угарным газом. С недавних пор мы знаем о волшебной роли NO в нашем организме – его небольшие молекулы регулируют работу сердечно-сосудистой и нервной системы (Нобелевская премия 1998 года). Они образуются в эндотелии, выстилающем стенки сосудов.
Свободно просачиваясь сквозь эндотелий, пропускающий молекулы размером менее 70кДа, гемоглобин связывает оксид азота и тем самым вызывает сужение просвета сосудов из-за неконтролируемого сокращения гладкой сосудистой мускулатуры, иначе называемого вазоконстрикцией. Именно этим объясняется в том числе его кардио- и нефротоксичность, от которых окончательно не избавлены все гемоглобиновые кровезаменители, применяющиеся в медицине.
Другие недостатки свободного гемоглобина – малый период действия препарата и олигурия из-за диссоциации молекул, а также быстрое окисление железа гема и интенсификация перекисного окисления липидов. Природой предусмотрены аж две специальные системы для связывания и обезвреживания высокотоксичного свободного гемоглобина в организме, но и у них есть предел работоспособности.
Чтобы избавиться от упомянутых побочных эффектов, исследователи стараются увеличивать размер молекул, переносящих кислород, за счет полимеризации гемоглобина. Крупная молекула массой 320 кДа уж точно не может проникнуть в эндотелий и связать там оксид азота. Кроме того, полимеризация сама по себе понижает степень сродства гемоглобина к кислороду, приближая его к таковому цельной крови. Полимеризуют гемоглобин главным образом при помощи глутарового альдегида, реже – о-раффинозы или диаспирина.
У полимеризованных гемоглобинов неожиданно обнаружились новые полезные свойства: они устойчивы к окислению при хранении, способны (в комплексе с гемопексином) повышать выделение эритроцитов из их депо при внутривенном введении, стимулировать кроветворение, а также дольше находиться в сосудистом русле – более суток.
Есть у полигемоглобина одно нехорошее побочное действие, о котором почему-то практически никто не упоминает. При введении кровезаменителя на основе свободного полигемоглобина в местах повреждения сосудов могут активироваться тромбоциты. Результат – повышенное тромбообразование, особенно у пациентов с сосудистыми заболеваниями.
Откуда берут свободный гемоглобин? Его извлекают из эритроцитарной массы человеческой крови с истекшим сроком годности, а также крови крупного рогатого скота. Животный гемоглобин даже лучше, чем человеческий – у него ниже сродство к кислороду. Еще одно преимущество коровьего гемоглобина – он существенно дешевле человеческого, и его намного больше. Другие экспериментальные гемоглобиновые препараты включают человеческий рекомбинантный гемоглобин, синтезируемый генномодифицированными бактериями Е. coli, а также рекомбинантный гибрид человеческих α-субъединиц и коровьих β-субъединиц гемоглобина.
Все кровезаменители на основе полигемоглобина в общем-то похожи друг на друга.
Вот их перечень.
1. Американский препарат НВОС-201, он же Hemopure, он же «Гемопюр», когда заявляется как отечественный (что отчасти правда, поскольку компания, собственно говоря, российская – ОПК «Биотех», она же Biopure, Cambridge, MA, USA). Препарат представляет собой полимеризованный гемоглобин крупного рогатого скота. Средний молекулярный вес – 250 кДа. Побочные эффекты включают в себя сужение просвета кровеносных сосудов, особенно артерий, повышение активности амилазы и липазы крови. В США FDA не выдало разрешение на этот препарат. Ограниченно используется в ЮАР, планируется к применению в России. Препарат Oxyglobin той же компании (отличается от Hemopure меньшей степенью очистки) в 80-е годы XX века применяли в ветеринарии (на собаках).
Разработчики утверждают, что из всех кровезаменителей этот – самый-самый безопасный, поскольку его можно использовать в более низких концентрациях (в 5—10 раз меньше) при сравнимой эффективности. Это, однако, явные признаки «хорошей мины при плохой игре». И вообще, информация по этому препарату крайне противоречивая и малопонятная. Вроде бы, с 2012 года этот препарат начали регистрировать в России. В 2016 году заявлено, что, дескать, закончена I фаза клинических испытаний. И тишина...
2. Еще один американский препарат в этом ряду – PolyHeme (Northfield Laboratories, Evanston, IL, USA). Препарат получают из эритроцитарной массы с истёкшим сроком хранения, гемоглобин полимеризуют при помощи глутаральдегида, молекулярная масса 128–256 кДа. Препарат якобы не дает побочных эффектов, таких как вазоконстрикция и нефротоксичность. Однако в декабре 2006 года компания-производитель представила предварительные результаты второй стадии клинических исследований, которые показали, что в группе получавших препарат возросло число смертельных исходов. Результаты III фазы клинических исследований показали трехкратное повышение случаев инфаркта миокарда по сравнению с контрольной группой (3% против 1%) испытуемых. И хотя исследователи пришли к выводу, что отношение пользы к риску использования препарата, когда нет натуральной крови, допустимо, в мае 2009 года FDA его отклонило.
3. Канадский кровезаменитель Hemolink (Hemosol Research Corporation, Mississauga, Ontario, Canada), в котором полигемоглобин стабилизирован трисахаридом раффинозой, поперечно связывающей β-цепи полипептида, оказался кардиотоксичным, поэтому его использование сильно ограничено. Судьба американского кровезаменителя HemAssist (Baxter, Deerfield, IL, USA), в котором альфа-цепи гемоглобина поперечно сшиты диаспирином, и вовсе печальна. Опыты на животных дали хорошие результаты, однако при испытании препарата на первой стадии клинических исследований выяснилась его высокая летальность, поэтому сегодня применение препарата приостановлено.
4. И наконец, OxyVita (OXYVITA, Inc. New Windsor, New York, USA) – потрясающий воображение препарат на основе полимерного гемоглобина крупного рогатого скота, обладающий просто невообразимой молекулярной массой – 17 МДа. К сожалению, примерно с 2014 года, когда его собрались подавать на клинические испытания, о нем нет никаких известий. Предполагаю, что препятствием к его клиническому применению могла стать чрезмерная вязкость, потому что семнадцать миллионов Дальтон – это, простите, уже гигантомания.
5 – 6. Далее – отечественные представители семейства полигемоглобиновых кровезаменителей. Все, как один – «уникальные», один другого «инновационней». Только вот почему-то все эти уникально-инновационные отличаются от «Геленпола» не более, чем первые «Жигули» от «Фиата».
Итак, «Геленпол» – первый, как заявляется, отечественный кровезаменитель, переносящий кислород, на основе модифицированного полимеризованного гемоглобина, полученного из эритроцитов донорской крови. Препарат создали сотрудники Российского НИИ гематологии и трансфузиологии МЗ РФ и НИИ высокомолекулярных соединений РАН в 1997 году. Его товарная форма представляет собой лиофильно высушенный полигемоглобин для внутривенного введения с молекулярным весом 150–200 кДа. К медицинскому применению препарат разрешен с 1998 года.
Наконец – еще одна новинка, российский препарат ПАМ-3 (рабочее название «Крунидон»), созданный неким «Альянсом компетенций ПАМ» на базе НПК «Медбиофарм», резидента Сколково. Представляет собой полигемоглобин крупного рогатого скота с молекулярной массой 192–320 кДа. Препарат хранится в лиофилизированной форме (до двух лет при температуре 4°С). Как заявляют разработчики, «мировых аналогов, обладающих свойствами полигемоглобина, не существует», хотя обоснований не приводят. Препарат разрабатывают с 2014 года. Пишут, что в 2016 году успешно завершена I клиническая фаза исследований.
 |
|
Морские полихеты Arenicola marina, а попросту – пескожилы, содержат в крови дыхательный пигмент, переносящий кислород. На его основе сегодня создают кровезаменители для человека |
Беспозвоночная
Луч надежды забрезжил в первом десятилетии XXI века, когда в Европе компания Hemarinа разработала ряд препаратов на основе внеклеточного дыхательного пигмента М101 морских полихет Arenicola marina. Среди них кровезаменитель – HEMOXYCarrier®; остальные представляют собой биодобавку к биотехнологическим средам (HEMOXCell®/ HEMUPStream®), аддитив для растворов консервации органов (HEMO2life®) и оксигенирующий перевязочный материал (HEMHealing®).
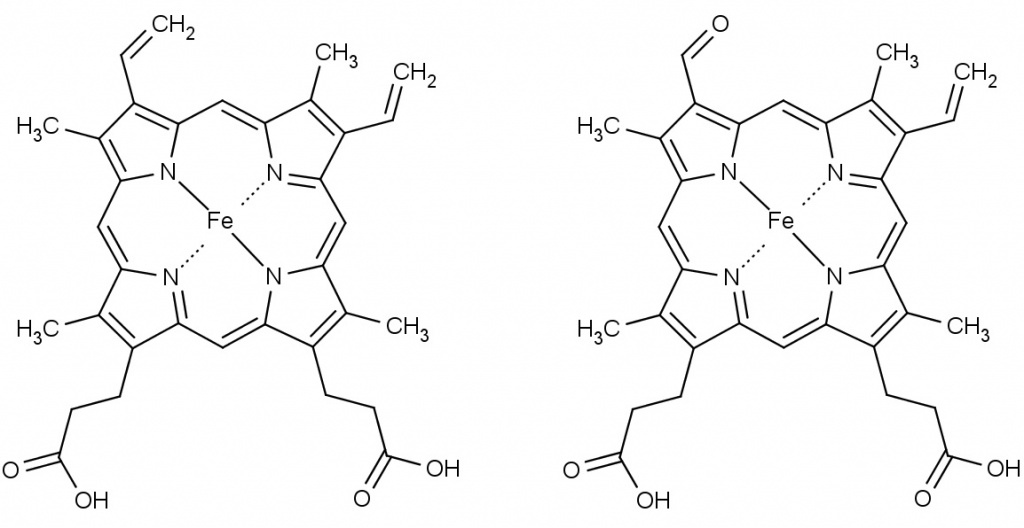
Откуда, собственно, этот М101 берется? Полихеты – это морские пескожилы, многощетинковые черви из семейства Arenicolidae. На вид – крупные дождевые червяки, только с жабрами (по одиннадцать штук с каждой стороны). В длину могут достигать 20 см, подобно ящерицам умеют отбрасывать хвост. Обитают в норках, которые роют в илисто-песчаном грунте. Их дыхательный пигмент М101 – типичный внеклеточный гемоглобин (эритрокруорины, хлорокруорины), плавающий в крови в виде свободных молекул, и совершенно не похож на внутриклеточные гемоглобины млекопитающих.
 |
|
Гем (слева), содержащийся в гемоглобине человека, и хлорокруонин (справа) в дыхательном пигменте червяков пескожилов – это комплексные соединения двухвалентного железа с порфиринами. Структурно они почти не отличаются друг от друга. И тем не менее, найдите одно отличие |
На самом деле M101 уже сам по себе аналог полигемоглобинового кровезаменителя: молекула пигмента имеет вес около 3,6 мДа, более чем в 55 раз (!) превосходя человеческий. Этот негликозилированный гексагонально-двуслойный (как показал рентгеноструктурный анализ) гемоглобин, состоящий из 156 глобинов и 44 неглобиновых линкерных цепей, обладает большой способностью связывать кислород (до 156 молекул кислорода при насыщении). Сродство этого дыхательного пигмента к кислороду при физиологических условиях почти в четыре раза ниже, чем у цельной крови человека. Кривая связывания кислорода имеет линейный характер (в этом он похож на перфторуглероды). Кроме того, этот уникальный пигмент проявляет еще и супероксиддисмутазоподобную активность, то есть отчасти предотвращает появление потенциально опасных активных форм кислорода и свободных радикалов. Опыты на мышах показали, что этот пигменты не вызывает иммунные и аллергические реакции, не влияет на сосуды и сердечный ритм. В интернете ходят вялые слухи, что в 2017 году якобы планируется к испытаниям отечественный кровезаменитель, тоже на основе дыхательных пигментов морских червей, создаваемый для военных нужд, однако данные по этому проекту весьма скудны.
Комплексная
Ни одна из перечисленных групп препаратов не совершенна, хотя на данный момент многие побочные эффекты гемоглобинов устранены за счет полимеризации молекул. Однако это не решает двух важнейших проблем.
Первая проблема – активные формы кислорода, которые не только высокотоксичны, но еще и вызывают спазм сосудов, препятствуя доставке кислорода тканям. Собственные же антиоксидантные системы крови пациентов способны нейтрализовать активные формы кислорода только до определенного предела.
Вторая нерешенная проблема – удаление CO2. Как я уже писал, в живых тканях (а тем более в эритроцитах) содержится достаточное количество фермента карбоангидразы, катализирующего переход углекислого газа и воды в гидрокарбонат и обратно, ускоряя его примерно в сотню раз. Вы, наверное, неоднократно видели, что пузырьки в газировках и игристых винах способны на воздухе выделяться чуть ли не часами. А добавьте туда карбоангидразу – и выделение углекислоты ускорится взрывообразно, жидкость просто вся вылетит из посуды в виде пены. В искусственных же и биосинтетических внеклеточных субстратах такого не предусмотрено.
В первых кровезаменителях исследователи не учитывали проблемы с CO2. Однако при замене до 40% крови кровезаменителем (при массивных кровопотерях) это смертельно опасно. С середины 90-х годов XX века эти проблемы, однако, были осознаны. Как я уже писал, исследователи нашли перспективные дыхательные пигменты морских полихет с супероксиддисмутазоподобными свойствами, которые способны не только переносить кислород, но и предотвращать появление активных радикалов кислорода – уже что-то.
Одновременно с этим в канадском Университете МакГилл в научно-исследовательском Центре искусственных клеток и органов научный коллектив под руководством профессора T.М. Ченга начал разрабатывать комплексы полигемоглобина с различными ферментами. В 2008 году появился первый растворимый комплекс полигемоглобина с супероксиддисмутазой и каталазой (polyHb-SOD-CAT) с антиоксидантной функцией. Зачем нужно было сразу два антиоксидантных фермента? Супероксиддисмутаза превращает супероксидные радикалы в кислород и пероксид водорода, а вот с пероксидом тоже нужно что-то делать. Вот каталаза как раз его и расщепляет на воду и молекулярный кислород.
Тогда-то, кстати, и обнаружилось, что если при 30%-ной замене крови оставшаяся карбоангидраза еще как-то справляется с возросшей углекислотной нагрузкой, то при 40%-ной замене крысы уже дохнут от отравления углекислым газом. Причем, что самое интересное, оказалось, что парциальное давление углекислоты (рСО2) в этих условиях совершенно не коррелирует с его концентрацией в тканях! В крови pCO2 может быть совершенно нормальное, а в тканях уже ацидоз.
Потому-то в 2011 году и был создан более совершенный растворимый комплекс polyHb-OD-CAT-CA (супероксиддисмутаза, каталаза и карбоангидраза) с антиоксидантной и СО2-транспортной функцией. В 2013 году успешно прошли опыты на крысах, которым заменяли две трети объема крови этими растворимыми комплексами. Крысы выживали.
Но профессор Ченг, человек увлекающийся, занялся искусственными форменными элементами крови. И дальнейшего прогресса в его комплексных кровезаменителях больше особо не видать. А так бы сродство к кислороду немножко подправить и с потенциальной активацией тромбоцитов что-нибудь сделать – и получился бы идеальный кровезаменитель!
Интересно, что по следам профессора Ченга примерно тем же самым в течение многих лет занимались в Воронежском государственном университете. В 2011 году воронежские исследователи создали полифункциональный полигемоглобинферментный комплекс, состоящий из молекул супероксиддисмутазы, каталазы и полигемоглобина различного состава с молекулярной массой 300-330 кДа. Приятно отметить, что этот российский препарат совершенней первого продукта Университета МакГилл – он обладает не только антиоксидантными, но также сосудорасширяющими и антитромбическими свойствами, не повреждает почки, не вызывает агрегацию эритроцитов и не приводит к нарушению осмотического давления в сосудах. К сожалению, по неизвестным причинам клинические испытания не проводились. Ограничились получением патента, кое-какими опытами на животных. Возможно, все уперлось в деньги. Точнее, в их отсутствие. Тем более – Воронеж, такое дальнее Замкадье...
В последние двадцать лет (видимо, в немалой степени под влиянием профессора Ченга – своего рода законодателя моды в этой области) внимание исследователей сместилось в сторону разработки микрочастиц инкапсулированного гемоглобина в различных гидрогелях и липосомах. Инкапсуляция потенциально способна увеличивать время работы кровезаменителя в сосудах, предотвращать проникновение свободного гемоглобина сквозь эндотелий, а также уменьшать реакцию со стороны иммунной системы. Однако она не снимает части требований к тому, что инкапсулировано, и потому никаких заслуживающих упоминания научных прорывов в этой области так и не случилось.
Подведем итоги
Полагаю, что читатели и сами уже сделали вывод. Из-за неконтролируемого выделения активных форм кислорода объем применения кровезаменителей, переносящих кислород, в организме ограничивается мощностью собственных антиоксидантных систем крови. То же самое относится к транспорту CO2. Основное количество карбоангидразы находится в эритроцитах, так что излишнее «разбавление» крови ведет к быстрому истощению буферных систем и неконтролируемому ацидозу. А уж о необходимости оснащать газотранспортные гемоглобиновые кровезаменители сосудорасширяющими и антитромобическими свойствами вообще никто, кроме воронежцев, не думал.
Применяемые в настоящее время в клинической практике гемоглобиновые (Hemopure®, PolyHeme® и отечественный «Геленпол») и перфторуглеродные («Перфторан») кровезаменители, имеют массу противопоказаний и побочных эффектов, а главное, ими можно заменять не более 30% объема циркулирующей крови (хотя на практике никто о таких бешеных цифрах и помыслить не мог). Но при таких объемах кровопотерь они просто не нужны – вполне достаточно обыкновенных плазмозамещающих растворов.
Поэтому все виды кровезаменителей нашли себе довольно узкую клиническую нишу – при широком спектре заболеваний и неотложных состояний, характеризующихся сосудистым спазмом и резким нарушением микрокровотока. Там они могут давать максимальный эффект при применении даже в малом объеме. Малый размер молекул кровезаменителей позволяет обеспечивать свободную доставку кислорода к клеткам ишемизированных тканей через резко суженные капилляры.
Применение и перфторуглеродов, и полигемоглобинов в этих областях ограничено из-за неблагоприятных последствий активных форм кислорода, порождаемых метаболической активностью клеток. Пока только один продукт, HEMOXCell®/ HEMUPStream® на основе М101, способен в какой-то степени бороться с этой проблемой.
Отсутствие подходящих кровезаменителей сегодня критично не только для медицины, но и для науки. Тканевая инженерия без средств доставки кислорода (помимо простой диффузии) вынуждена ограничивать себя объектами толщиной 1–1,5 мм, чтобы обеспечить выживаемость клеток в синтетических тканевых матриксах. Способов доставки кислорода к клеткам в тканевой инженерии придумано много, но все они по большей части малоэффективны, а иногда и откровенно нелепы и даже опасны. Не стану указывать фамилии авторов методик, чтобы не позорить лишний раз людей.
Пока реальным потребностям тканевой инженерии отвечают только банальная эритроцитарная масса, а также (в некоторой степени) продукты компании Hemarinа на основе внеклеточного дыхательного пигмента M101. Однако эритроцитарная масса не слишком удобна. Эритроциты требуют титанических усилий по соблюдению стерильности, быстро повреждаются, забивают все фильтры, а высвобождающийся из них свободный гемоглобин крайне токсичен (из-за тут же образующихся в его присутствии активных форм кислорода).
К сожалению, несмотря на обилие как научных работ, так и предлагаемых продуктов, вынужден сделать вывод: пригодного к практическому использованию полноценного кровезаменителя с газотранспортной функцией пока что не существует.
Если говорить о текущих тенденциях в сфере прогресса (хотел было написать «инновационных», но это слово скоро, похоже, станет ругательным), то они таковы – причем не только в России! – победно трубить на каждом шагу про инновации и грядущее избавление человечества. А как дойдет до дела (особенно в дискурсе финансирования), так сразу «денег нет, но вы держитесь…» А по сути – «За старину, против всякой новины!»