Как зажечь огонь
Неистов и упрям,
Гори, огонь, гори,
На смену декабрям
Приходят январи.
Булат Окуджава
Первый огонь
Горение — первая химическая реакция, с которой познакомился первобытный человек. И научился примитивно ею управлять, добавляя в нужное время сучья в костер. Тысячи лет огонь использовали для обогрева, приготовления пищи, освещения. Вокруг костра или очага проходила вся общественная жизнь людей. Непередаваемая игра языков пламени запечатлелась в общественном сознании, поэтому любое пламя — свечей, костра, пожара — и в XXI веке так завораживающе действует на человека.
Овладение огнем немало способствовало тому, чтобы человек разумный занял господствующее положение на планете. Вероятно, одним из первых религиозных представлений стало поклонение огню. В Индии в древнейших гимнах «Ригведы» воспевается Агни — бог огня, домашнего очага и жертвенного костра, по числу упоминаний он занимает второе место после Индры, главы всех богов. Именно от древнего индоевропейского корня произошли и латинское ignis, и русское «огонь»; этот корень есть во всех славянских языках, и не только в них (по-литовски огонь — ugnis, по-латышски — uguns, да и по-английски igneous — огненный).
Первый использованный человеком огонь был нерукотворным: его зажгла молния или вулканическая лава. Вид горящего леса вызывал панический ужас у всего живого. «Красным цветком... называли огонь, — пишет Редьярд Киплинг в «Книге джунглей», — потому что ни один зверь в джунглях не назовет огонь его настоящим именем. Все звери смертельно боятся огня». Человек сумел преодолеть страх и приручил огонь. Многие мифы связывали овладение огнем с древними героями, похитившими его с неба. Самый известный — миф о Прометее; дав людям огонь, он был за это жестоко наказан богами.
Вспыхнувшее от удара молнии дерево — редкое явление, поэтому сохранение огня было важным ритуалом. Потеря огня, особенно в холодное время, была почти эквивалентна потере жизни. Отсюда многие древние и современные ритуалы: жрецы в храмах поддерживали неугасимый огонь, горят свечи в христианских храмах, по субботам зажигают свечи иудеи, в память о погибших горит Вечный огонь, перед очередными Олимпийскими играми из Греции несут олимпийский огонь.
Вплоть до ХХ века огонь был единственным средством не только обогрева и получения механической работы в паровых машинах, но и освещения. Улицы и помещения освещались факелами или плошками с растительным маслом или животным жиром (изредка для этих целей использовали спермацет — воскообразное вещество из головы кашалота). Затем их сменили свечи (восковые и более дешевые стеариновые и парафиновые), керосиновые лампы и газовые фонари. Однако в свет переходит лишь ничтожная часть энергии пламени (десятые доли процента), в основном она выделяется в виде теплоты.
В течение многих веков огонь добывали трением, а затем — ударом кресала о кремень (см.: Огонь без спичек и зажигалок, «Химия и жизнь» № 3, 2009). Искры при ударе давал, в частности, минерал пирит, откуда и происходит его название.
Наконец, зажигалка
В 1770 году была изобретена электрическая зажигалка, в которой струя водорода воспламенялась от искры электрофорной машины. Такая зажигалка могла служить для красивых демонстраций на лекции, но не для использования в быту. Появление зажигалки, какой мы ее знаем, связано с именем немецкого химика Иоганна Вольфганга Дёберейнера. Одно из важнейших его открытий — катализ: способность мелкодисперсной платины (платиновой черни) инициировать протекание ряда химических реакций; при этом сама платина не претерпевает изменений. В 1821 году Дёберейнер обнаружил, что платиновая чернь окисляет пары винного спирта до уксусной кислоты уже при обычной температуре. Через два года он открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идет сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, губка раскаляется и гремучий газ может взорваться. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек. В нем струя водорода, получаемого действием цинка на раствор серной кислоты, направлялась на мелкодисперсную платину и загоралась.

|
| Иоганн Вольфганг Дёберейнер (1780–1849), открыл явление катализа. На марке ГДР (1980) он изображен рядом со своей каталитической горелкой. |
В 1862 году голландский промышленник Петрус Якоб Кипп сконструировал аппарат для получения водорода, ныне носящий его имя. Эту конструкцию использовали и в водородном огниве: выходящую из аппарата струю водорода направляли на губчатую платину. Придя с ней в соприкосновение в присутствии воздуха, водород воспламенялся. Конечно, аппарат Киппа в карман не положишь; прибор мог быть только стационарным. «Водородное огниво» быстро вытеснило спички, сначала опасные фосфорные, потом безопасные серные. Однако спички легко отсыревают, пламя задувается ветром, на производство спичек тратится древесина, для их изготовления используется опасная бертолетова соль. Альтернативой спичкам служат зажигалки. Раньше их заправляли бензином. Бензин пропитывал фитиль, испарялся, и его пары поджигались искрой, получаемой от трения стального колесика о маленький цилиндрик, сделанный из специального сплава. Этот сплав изобрел австрийский химик Карл Ауэр фон Вельсбах, воспользовавшись удивительным свойством церия: если проволоку из этого металла поскрести ножом, то образующиеся мельчайшие пылинки самовоспламеняются на воздухе (такое свойство называется пирофорностью — от греческих слов pyr — огонь и phoros — несущий). Ауэр усилил пирофорность церия, сплавив его с другими металлами. Получился сплав (так называемый мишметалл, от немецкого mischen — смешивать), который при ударе или энергичном трении о стальное колесико дает множество искр, и они легко поджигают фитиль. Для зажигалочных кремней оптимален состав: церий — 66%, лантан — 8%, железо — 25%, магний — 0,5%, медь — 0,5%. Зажигалки позволили сэкономить во всем мире бесчисленное количество спичечных коробков.
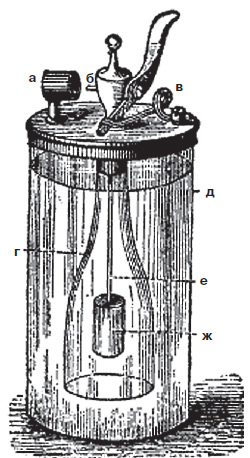
|
| Водородное огниво Дёберейнера. Зажим для губчатой пластинки (а), сопло (б), прижимная пружина (в), открытый сосуд (г), цилиндр (д), штифт (е), цинковый цилиндр (ж) |
Аналогичный сплав на основе церия используется в трассирующих пулях и снарядах. Специальная насадка из пирофорного сплава надета на снаряд снаружи, а роль «колесика» в зажигалке, высекающего искру, играет воздух. При больших скоростях трение насадки о воздух заставляет снаряд искрить, и путь его легко проследить.
Бензиновые зажигалки со временем уступили место более удобным газовым. В них под небольшим давлением находится сжиженный газ — бутан или его смесь с пропаном. Механизм поджига прежний: колесико и кремень. В новых конструкциях нет движущихся деталей, зажигание производит тонкая нихромовая проволока, накаляемая током, либо искра, которая проскакивает между двумя электродами. В обоих случаях в зажигалке должен быть источник энергии — батарейка. Альтернатива — пьезоэлектрические зажигалки, которые не требуют дополнительных источников питания: при сжатии некоторых кристаллов в них генерируется высокое напряжение, которое и создает искру. Сравнительно недавно венгерские изобретатели, вспомнив «огниво» Дёберейнера, сконструировали зажигалку нового типа: на выходе струи газа находится платиновая спиралька, которая катализирует реакцию горения. Пламя у новой зажигалки сильное и устойчивое, ему не страшен ветер. Таким пламенем можно не только поджечь сигарету, но и сварить при необходимости тонкую проволоку.
История спички
Водородное «огниво» Дёберейнера было громоздким и непереносным прибором. В 1831 году французский студент Шарль Сориа, которому тогда было 19 лет, придумал намазывать на деревянные палочки смесь из белого фосфора, бертолетовой соли, растительной камеди и некоторых добавок. Достаточно было чиркнуть такой спичкой о любую шероховатую поверхность (например, о подошву башмака), как повышение температуры в результате трения немедленно вызывало бурную взрывную реакцию
5KClO3 + 6P = 5KCl + 3P2O5,
приводящую к воспламенению спички. Однако у Сориа не было денег, чтобы запатентовать свое изобретение; он не смог также наладить массовое производство спичек. Спустя два года это сделал немецкий химик Иоганн Каммерер.
Фосфорные спички стали популярны, спрос на белый фосфор возрос, в Германии и Франции начали строить фабрики по производству фосфора путем прокаливания смеси фосфорной кислоты с древесным углем:
2Н3РО4 = Р2О5 + 3Н2О;
Р2О5 + 5С = 2Р + 5СО.
В 1844 году фосфор начали получать в Англии, а затем и в других странах. В Россию фосфорные спички впервые попали в 1836 году, и в последний год своей жизни иностранной новинкой в принципе мог воспользоваться А. С. Пушкин. Вскоре в Петербурге была открыта фабрика «по выделыванию зажигательных спичек», а к 1882 году в России было уже 263 спичечные фабрики! В результате цена спичек снизилась в 20 раз.

|
| Янош Ирини изображен на венгерской марке (1954). Дата рождения на марке указана неверно, Ирини родился в 1817 году. |
Однако фосфорные спички были чрезвычайно опасны. И производство, и потребление этих спичек сопровождались многочисленными пожарами и отравлениями. Среди «тургеневских барышень» пользовался популярностью такой способ самоубийства: с головок спичек соскабливался фосфор и выпивался с водой. Известен случай гибели от ожогов женщины, наступившей на фосфорную спичку: от загоревшейся спички вспыхнуло ее платье. В конце концов фосфорные спички были запрещены почти во всех странах (в России — в 1875 году).
Менее опасными оказались «бесшумные спички», которые изобрел венгерский химик Янош Ирини. Он заменил в головке спички бертолетову соль на менее сильный окислитель — диоксид свинца, и реакция окисления фосфора пошла спокойнее:
5PbO2 + 2P = 5PbO + P2O5.
Однако любые усовершенствования ничего не могли поделать с ядовитостью белого фосфора. Проблема была решена, когда на смену фосфорным пришли так называемые безопасные (они же шведские) спички. Произошло это только после того, как в 1847 году австрийский химик Антон Шрёттер фон Кристелли обнаружил, что, если белый фосфор нагревать в герметичном железном сосуде, он превращается в неизвестную до этого разновидность — красный фосфор. (Шрёттер сделал еще одно замечательное изобретение: он первым рекомендовал дамам использовать перекись водорода для обесцвечивания волос.) Шведские спички были изобретены в 1848 году, однако не шведом, а немецким химиком Рудольфом Бёттгером. Он догадался, что красный фосфор надо отделить от сильного окислителя — бертолетовой соли. Название новые спички получили из-за того, что впервые их массовое производство наладили в 60-е годы XIX века братья Лундстрём в Йенчёпинге на юге Швеции.
В современных спичках красный фосфор входит только в состав намазки на коробке (к нему может быть добавлен сульфид фосфора P4S3). В намазке находятся также сульфид сурьмы Sb2S3, мумия Fe2O3 (или свинцовый сурик Pb3O4), мел, молотое стекло, костяной клей, некоторые другие вещества. Горючие вещества есть и в спичечной головке — это сера с добавкой сульфида сурьмы или фосфора, а окислителем служит бертолетова соль KClO3 (к ней могут добавляться также другие окислители — дихромат калия K2Cr2O7, диоксид марганца MnO2, хромат бария BaCrO4, диоксид свинца PbO2). Кроме того, в головке есть оксид цинка ZnO, молотое стекло, костяной клей, мумия или сурик. При трении головки спички о намазку мельчайшие частички красного фосфора на боковой поверхности коробки воспламеняются и поджигают головку спички, при этом в основном идет реакция
3S + 2KClO3 = 3SO2 + 2KCl.
Реакция эта происходит настолько быстро (чистая смесь серы с бертолетовой солью взрывается от удара), что осиновая основа спички не успевает загореться; легче загорается парафин, которым пропитана верхняя часть спички, а горящий парафин уже поджигает древесину. В общем, настоящий химический завод.
Гори, свеча, гори
В наиболее распространенном типе пламени горючее вещество и окислитель поступают в зону горения независимо и в этой зоне реагируют, образуя пламя. Идеальной и в то же время достаточно простой его моделью такого пламени может служить обыкновенная свеча — одно из наиболее совершенных изобретений человека, не утратившее до сих пор своего значения. В отличие от лучины, свеча горит довольно медленно, без копоти, в течение многих часов давая ровное и сравнительно яркое пламя. До изобретения электрического освещения просторные залы и дворцы освещались сотнями и тысячами свечей.
В общих чертах процессы, происходящие при горении свечи, были выяснены еще в позапрошлом веке. В декабре 1860 года английский физик Майкл Фарадей прочитал в большом зале Королевского института в Лондоне шесть публичных рождественских лекций «Химическая история свечи». В этих лекциях, предназначенных в основном для подростков, Фарадей подробно рассказал о своих исследованиях по физике и химии горения и показал ряд простых и поучительных опытов.
Фарадей не записывал своих лекций. К счастью, присутствовавший на его лекциях молодой английский химик Уильям Крукс, впоследствии президент Королевского общества (Английской академии наук), записал лекции Фарадея и издал их, сопроводив иллюстрациями и комментариями. Еще при жизни Фарадея книга «История свечи» была в 1866 году переведена на русский язык, а затем несколько раз переиздавалась.
Во времена Фарадея свечи делали чаще всего из стеарина (от греч. stear — жир, сало) — жирной на ощупь полупрозрачной массы белого или желтоватого цвета. Это смесь твердых жирных кислот с общей формулой CnH2n+1COOH, среди которых преобладает стеариновая кислота (обычно с примесью пальмитиновой и олеиновой). Стеарин плавится в интервале 50–65°C, что очень удобно для изготовления и эксплуатации свечей. Когда-то производство стеарина для свечей было важной отраслью промышленности (достаточно сказать, что в Энциклопедическом словаре Брокгауза и Ефрона стеарину посвящено около семи страниц мелкого текста и 16 рисунков, тогда как в современной пятитомной Химической энциклопедии — всего четыре строчки).
Сейчас свечи делают в основном из парафина — бесцветного воскообразного вещества, который состоит из смеси твердых предельных неразветвленных углеводородов состава CnH2n+2, содержащих от 16 до 30 атомов углерода в молекуле. Парафин легче воды, легко плавится (при 45–65°C). Его получают главным образом при переработке нефти, которая, в зависимости от месторождения, может содержать от долей процента до 20% и более парафина. Парафин при комнатной температуре химически инертен, а при высокой температуре легко сгорает с выделением углекислого газа и воды, почти не образуя копоти. Парафином пропитывают часть спички, прилегающей к головке, чтобы древесина легче загорелась.
Для правильного горения свечи очень важен фитиль, который должен сгорать без остатка одновременно с парафином. Современный фитиль делают из хлопчатобумажных нитей, пропитанных солями фосфорной и борной кислот. Эти вещества способствуют тому, что целлюлоза, из которой состоит в основном хлопок, сгорает без остатка. А когда-то снятие нагара со свечей было проблемой; для этого выпускали специальные щипцы. Важен и диаметр фитиля: слишком толстый даст коптящее пламя, а у слишком тонкого пламя будет маленьким и может погаснуть. Скорость, с которой сгорает свеча, зависит, помимо прочего, от скорости притока воздуха в зону горения. Нагретый пламенем горячий воздух поднимается вверх, а на его место снизу и сбоку приходят струи холодного воздуха. Он охлаждает верхний ободок свечи и не дает расплавиться находящемуся там воску, поэтому расплавленный воск оказывается в «чашечке» из твердого воска и не выливается. Космонавт в космическом корабле, находящемся на земной орбите, не смог бы наблюдать за горящей свечой: в отсутствие силы тяжести горячий воздух вверх не поднимется, а свежий не сможет подойти к зоне горения, и свеча погаснет.
После зажигания свечи огонь быстро растапливает часть парафина около фитиля, образуя небольшую лужицу. Жидкий парафин капиллярными силами поднимается по фитилю вверх, как вода от корней растения к ветвям и листьям. Добравшись до горячей зоны, парафин частично испаряется, а частично разлагается. Испаряются в основном более легкие парафиновые углеводороды. Температура в самой верхней части горящего фитиля составляет около 600°C. Этого вполне достаточно, чтобы закипели и более тяжелые углеводороды. Так, гексадекан С16Н34 кипит при температуре 286,8°C, эйкозан С20Н42 при 343°C, докозан С22Н46 при 368,6°C. Но тяжелые углеводороды при высокой температуре и атмосферном давлении не кипят, а разлагаются. Практически сразу же после испарения разлагаются в горячей зоне и легкие углеводороды; продукты разложения запускают целый каскад сложных химических превращений, о которых еще пойдет речь.

|
| Темная сердцевина свечного пламени хорошо видна простым глазом. Фото: А. Константинов |
Непосредственно над горящим фитилем легко заметить темный несветящийся конус, температура в его нижней части равна 800°C, а в верхней — 1000°C. В эту часть пламени кислород почти не доходит. Темный конус окружен желтым пламенем, которое и испускает свет; его температура — 1200°C. А сбоку от желтого пламени, в основном в нижней его части, виден тонкий слой голубого огня — это самая горячая часть пламени, ее температура — 1400°C (температура в разных участках пламени была измерена с помощью микротермопар). Все эти особенности пламени, которые характерны не только для свечи, объясняются различными химическими процессами — в каждой зоне пламени они свои.
Свечение твердых тел и газов зависит от температуры. Чем выше температура, тем чаще сталкиваются атомы и молекулы. Энергия столкновения передается электронам, которые переходят на более высокий энергетический уровень. Самопроизвольное возвращение электронов в исходное состояние сопровождается излучением квантов света — фотонов. Если нагревать твердое тело, то по мере повышения температуры его цвет постепенно переходит от красного к желтому и, наконец, белому. Свечение же раскаленных частиц в газах зависит от их химической природы. Так, возбужденные атомы ртути в люминесцентных лампах испускают много невидимых ультрафиолетовых лучей, атомы гелия испускают желтый свет, неона — оранжевый, аргона — зеленовато-голубой и т. д. Атомы ртути и благородных газов в трубках возбуждаются электрическим разрядом. В пламени возбуждение электронов происходит не только из-за высокой температуры, но и за счет энергии разнообразных химических реакций.
Цвет пламени зависит от природы возбужденных частиц, находящихся в зоне горения. Так, горящий магний испускает ослепительный белый свет — это светится раскаленный теплотой реакции ее продукт — твердый оксид магния MgO. Возбужденные атомы, а также частицы, состоящие из нескольких атомов, испускают свет определенных длин волн, на этом основан спектральный анализ. Испускание света раскаленными частицами используется в пиротехнических составах — смесях горючего вещества, окислителя и веществ, окрашивающих пламя (обычно это соли металлов). При высокой температуре, которую дает горящий состав, соединения металлов светятся разными цветами: стронций дает карминово-красный цвет, натрий — желтый, барий — зеленый, медь — синий. Искрящиеся «звездочки» содержат порошки металлов (магния, алюминия). Порох, смешанный с чугунными опилками, дает при сгорании красивый сноп искр. Небольшой и безопасный «фейерверк» можно устроить дома с помощью корки мандарина или апельсина. Если сильно сжать корку, из нее брызнет струйка жидкости, содержащей эфирное масло: направленная на огонь, струйка дает в воздухе красивые вспышки пламени.
Фарадей тоже иллюстрировал свои лекции простыми опытами, которые легко повторить в домашних условиях.
С помощью тонких стеклянных трубочек он выводил вещества из разных участков пламени и показывал, что одни из них представляют собой еще не сгоревшую сажу, другие — горючие газы, которые можно поджечь на другом конце трубочки. Похожий опыт можно воспроизвести с помощью листа бумаги, свернутой в виде конуса. Если поджечь широкую часть бумажного конуса, расположенного горизонтально, из его узкой части начнут выделяться пары — продукты неполного разложения целлюлозы. При поджигании эти пары загораются. Продукты неполного сгорания обусловливают запах, который появляется, когда свечу гасят. Эти продукты в виде белого дымка можно быстро поджечь спичкой или зажигалкой (их нужно держать наготове зажженными), и тогда пламя снова охватит фитиль, «спустившись» на него сверху. Легко обнаруживается и один из продуктов горения — пары воды: если подержать над пламенем холодный и достаточно массивный (чтобы не нагрелся) металлический предмет, он покроется капельками воды.
В заключение — об одной ошибке. Иногда на уроках показывают такой опыт: в тарелку с водой пускают плавать деревянный или пенопластовый кружок, на котором укреплена горящая свеча. На кружок со свечой опускают перевернутую стеклянную банку и ставят ее в таком виде на дно сосуда с водой. Через некоторое время свеча гаснет, и примерно пятая часть банки заполняется водой. Опыт якобы показывает, что лишь пятая часть воздуха (кислород) поддерживает горение, однако эффект объясняется нагревом воздуха при горении свечи и его охлаждением при прекращении оного. Так что опыт не иллюстрирует состав воздуха, а подтверждает высказывание Фарадея: «Явления, наблюдающиеся при горении свечи, таковы, что нет ни одного закона природы, который при этом не был бы так или иначе затронут».
