Происхождение мембран и мембранной биоэнергетики
В прошлом номере мы проследили происхождение геномной ДНК и механизмов ее репликации — от РНК-белкового мира до больших кольцевых молекул ДНК, составляющих геномы бактерий и архей. Попробуем теперь путем сравнения бактерий и архей узнать структуру мембран их общего предка.
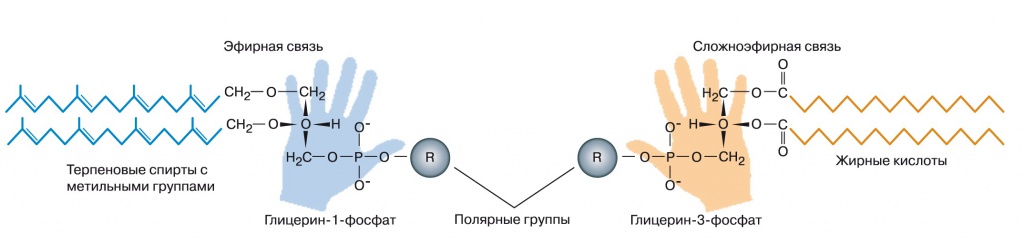
Мембраны современных бактерий состоят из фосфолипидов — сложных эфиров глицерина, двух остатков жирной кислоты и одного фосфатного остатка. К фосфатному остатку может быть присоединена дополнительная полярная группа — этаноламин, холин, аминокислота серин или многоатомный спирт инозитол. Гидрофобные хвосты жирных кислот образуют средний слой мембраны, а полярные остатки глицерина, фосфата и вспомогательных полярных групп — наружный и внутренний слои. Мембраны архей устроены в принципе похоже, но на другой химической основе. Вместо жирных кислот их липиды содержат терпеновые спирты, например геранилгераниол, углеводородные цепочки которых несут метильные группы через каждые четыре атома. Эти спирты простыми эфирными связями присоединяются к глицеринфосфату, фосфатный остаток может дополняться другими полярными головками, такие же, как у бактерий. Сам глицеринфосфат архей тоже отличается от бактериального — у архей используется другой его оптический изомер, глицерин-1-фосфат вместо глицерин-3-фосфата (рис. 1).
|
| 1. Строение мембранных липидов бактерий (справа) и архей (слева) |
Таким образом, сравнение мембран у современных организмов ничего нам не дает — все их основные компоненты отличаются до полной несовместимости. Одну из крайних точек зрения высказали Уильям Мартин и Майкл Рассел («Philosophical Transactions of the Royal Society, B, Biological Science», 2007, 362, 1887—1925, doi: 10.1098/rstb.2006.1881): последний общий предок вообще не имел мембран — предки бактерий и архей изобрели современные мембраны независимо при выходе из пор в минеральных отложениях.
Другая крайняя точка зрения основана на обнаружении жирных кислот в метеоритах и в условиях опыта Миллера. Согласно ей, примитивные мембраны, состоящие из абиогенно синтезированных жирных кислот, существовали еще на заре мира РНК, до появления белков. Обе эти крайности, скорее всего, неверны.
В реконструированном арсенале белков LUCA (напомним, что так называют «последнего общего предка», от last universal common ancestor) есть несколько трансмембранных белков, таких, как мембранная АТФаза и система секреции белков III типа. А у кого есть белки, сидящие в мембране, у того должна быть и мембрана. Что до абиогенных жирных кислот, у них велик разброс по длине углеводородной цепи, и поэтому из их смеси получаются крайне непрочные мембраны. Гюнтер Вахтерхойзер предполагал, что LUCA имел смесь липидов с обоими изомерами глицерина, а бактерии и археи унаследовали по одному типу из этих двух («Philosophical Transactions of the Royal Society, B, Biological Science», 2006, 361, 1787—1806, doi: 10.1098/rstb.2006.1904). Однако когда такие мембраны были получены искусственно, оказалось, что липиды с разными изомерами глицерина быстро разделяются на «острова», содержащие преимущественно один изомер из двух, а мембрана легко рвется по границам этих «островов».
Исследуя происхождение мембран, мы встречаемся с очередным парадоксом «курицы и яйца». Современные мембраны непроницаемы для ионов металлов и заряженых органических молекул, таких, как аминокислоты, и слабо пропускают сахара. Чтобы клетки могли поглощать органические вещества из внешней среды, мембрана содержит десятки видов транспортных белков. Клетка с мембраной, лишенной транспортных белков, обречена на голод, а транспортные белки не могут возникнуть в отсутствие мембран. Хуже того, синтез мембранных белков в современных клетках невозможен без мембранного белкового комплекса SRP, который связывается с рибосомой и помогает встроить в мембрану выходящую из нее белковую цепь. В отсутствие SRP гидрофобный участок пептида, который должен быть в мембране, просто застревает на выходе из рибосомы! (См. статью Мулкиджаняна, Гальперина и Кунина, «Trends in Biochemical Science», 2009, 34, 206—215, doi: 10.1016/j.tibs.2009.01.005)
Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза всех компонентов липидов бактерий, архей и эукариот («Biochimica et Biophysica Acta — Bioenergetics», 2012, 1817, S154. doi: 10.1016/j.bbabio.2012.06.404; кстати, первый автор этой статьи — аспирантка Мулкиджаняна Дарья Диброва; «Nature Reviews Microbiology», 2012, 10, 7, 507—515. doi: 10.1038/nrmicro2815).
Родственными у архей и бактерий оказались ферменты для 1) синтеза терпеноспиртов (бактериям они тоже нужны, хотя и не для мембран) и 2) пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. И синтез глицеринфосфата, и синтез жирных кислот возникли лишь после разделения линий бактерий и архей. Следовательно, проще всего предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны, по сравнению с современными, обладают высокой подвижностью, текучестью и хорошо пропускают ионы металлов и малые органические молекулы. Это позволяло древним протоклеткам поглощать готовую органику из внешней среды даже без специальных транспортных белков.
Еще один аргумент в пользу того, что древние мембраны содержали терпены, а не жирные кислоты, — особенности путей синтеза тех и других. Длинные цепи жирных кислот синтезируются одним ферментным комплексом, путем последовательного добавления двухуглеродных «кирпичиков» по одному. Чтобы получить жирные кислоты одинаковой длины (а следовательно — и прочную мембрану), нужны достаточно точные и совершенные ферменты. Терпены же синтезируются из более крупных пятиуглеродных строительных блоков изопентилпирофосфата, которые сначала собираются в десятиуглеродные молекулы геранилпирофосфата, а затем, при помощи другого фермента, — в двадцатиуглеродные зрелые спирты (геранилгераниол, кальдархеол, фитол и другие). Требования к точности и специфичности ферментов при такой крупноблочной сборке гораздо ниже.
Первые белки могли встраиваться в мембрану с помощью механизма «выворачивания». Для этого белок не должен иметь участков, которые состояли бы исключительно из гидрофобных аминокислот, а только зоны чередования гидрофобных аминокислот с гидрофильными, примерно две через две. Такой белок может выходить из рибосомы без помощи SRP и достаточно растворим в воде. Чередование «2 через 2» создает альфа-спиральные участки, у которых один бок гидрофобный, а другой гидрофильный. В водорастворимой форме такой белок сворачивается гидрофобными участками внутрь, а попадая на мембрану, разворачивается по ней плоско. Затем его альфа-спирали могут опять собраться компактно, но уже гидрофобными участками наружу. Гидрофильные стороны спиралей образуют при этом пору в мембране, через которую могут проходить вода, ионы, полярные молекулы и даже белки и ДНК. Подобным образом и сейчас попадают в мембрану некоторые белки-токсины, которые синтезируются одной клеткой, а должны встроиться в мембрану другой.
Теперь перейдем к той роли, которую играют современные мембраны в запасании и передаче энергии. Громадное большинство современных организмов синтезирует АТФ — «энергетическую валюту» клетки с помощью мембранных электрохимических процессов. Их главная движущая сила — протонный градиент, избыток ионов Н+ на наружной стороне мембраны по сравнению с внутренней.
В общем виде процесс выглядит так. Ферментные комплексы электрон-транспортных цепей проводят окислительно-восстановительные реакции, сопряженные с переносом ионов водорода через мембрану изнутри наружу. Затем ионы водорода входят в клетку через специальную мембранную АТФ-синтазу, которая, в свою очередь, сопрягает движение протонов с синтезом АТФ. Работа электрон-транспортных цепей и АТФ-синтазы — конечный этап превращения энергии, выручаемой при окислении питательных веществ, в энергию связей между фосфатами АТФ, иными словами, в молекулярное топливо, которое клетке удобно использовать.
Тот же электрохимический протонный градиент используется для транспорта молекул в клетку и для вращения бактериальных жгутиков. Компоненты электрон-траспортных цепей очень разнообразны, подстраиваются к условиям обитания клетки, и их гены подвержены горизонтальному переносу.
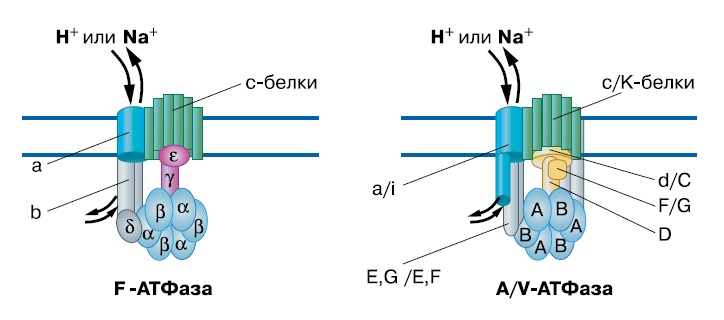
Мембранные АТФ-синтазы более консервативны. Они делятся на два семейства: F и A/V, которые несколько отличаются по набору субъединиц. F-ATФ-синтазы встречаются у бактерий, в митохондриях и пластидах эукариот, тогда как A/V — у архей (A) и в вакуолях эукариот (V). Мембранные АТФ-синтазы обратимы — они могут или впускать протоны в клетку, синтезируя при этом АТФ, и откачивать из клетки с затратой энергии — гидролизом АТР. Во втором режиме обычно работают вакуолярные АТФазы, закисляющие среду в лизосомах (внутриклеточных пузырьках, где разрушаются ненужные структуры).
С этим механизмом стоит познакомиться поближе. Те, кто утверждают, что «природа не изобрела колеса», не знают молекулярной биологии. АТФазы обоих семейств состоят из вращающейся части — «ротора» и неподвижной — «статора». «Ротор» — кольцо из 10—15 мелких с-субъединиц в мембране и стержень в цитоплазме. Погруженный в мембрану «статор» соединен боковым стержнем с кольцом из трех А и трех В субъединиц. Статор и с-субъединицы образуют карманы для протона, по одному с каждой стороны мембраны. Чтобы ион мог пройти из кармана в карман и пересечь мембрану, с-кольцо должно повернуться. Каждый ион делает полный круг вместе с ротором, и при каждом повороте с-кольца на одну субъединицу очередной ион покидает АТФазу.
Молекулы АТФ связываются между A и В субъединицами цитоплазматического «статора», три АТФазных центра становятся активными поочередно при вращении стержня ротора внутри АВ-кольца. Таким образом, за один оборот молекулярного комплекса через мембрану переносится от 10 до 15 протонов (по числу с-субъединиц) и синтезируется либо гидролизуется три молекулы АТФ. Синтез АТФ за счет переноса протонов по градиенту часто сравнивают с вращением колеса за счет давления воды, а обратный процесс — с насосом, накачивающим воду вверх; как и все сравнения макромира с микромиром, это сравнение не совсем точно, но общую картину оно отражает (рис. 2).
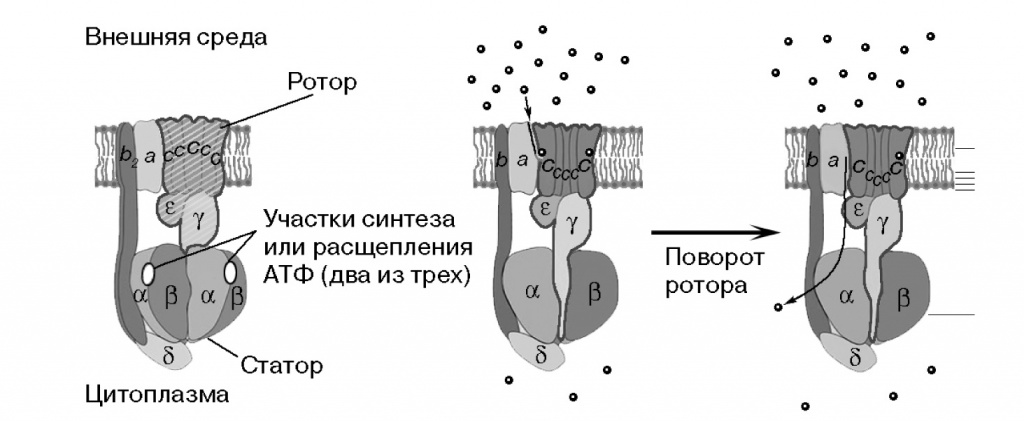 2-1. Строение АТФ-синтазы F-типа (по: www.atpsynthase.info/FAQ.html). Слева — боковая проекция этого молекулярного механизма; ротор — вращающаяся часть — обведен контуром и заштрихован. Справа тот же механизм в разрезе, показано прохождение одного иона H+ или Na+ через канал АТФ-синтазы. По адресу www.mrc-mbu.cam.ac.uk/research/atp-synthase можно найти анимированную схему ее работы. Подробнее и с пояснениями — http://vcell.ndsu.nodak.edu/animations/atpgradient/index.htm |
Каким образом возникло такое изощренное устройство? Есть ли в клетке более простые структуры, похожие на его «детали»? Да, есть. Основные субъединицы АТФ-синтазы и их взаимное расположение напоминают систему секреции белков III типа. (Эта общая для бактерий и архей система активно выделяет белки из клетки, развернув их до альфа-спиралей, с затратой АТФ и вращением выделяемого белка.) А и В-субъединицы статора также обладают более далеким, но достоверным сходством с хеликазами семейства Rho и белком RecA. Эти белки образуют кольца из шести одинаковых субъединиц, которые вращаются вокруг ДНК, расплетая ее за счет энергии АТФ. Таким образом, мембранная АТФ-синтаза происходит от древнего семейства вращающихся АТФаз с разнообразными функциями.
Субъединицы F и A/V АТФ-синтаз гомологичны между собой за исключением стержня ротора — между стержнями F и A/V семейств нет ничего общего. Поскольку стержень необходим для передачи вращения от с-кольца к АВ-кольцу, то есть для сопряжения ионного транспорта с синтезом АТФ, это означает, что общий предок F и A/V АТФаз не мог сам быть ион-движущей АТФазой. Скорее всего, два семейства АТФаз возникли независимо из системы секреции белков: в обоих случаях выделяемый белок застрял в ней и начал передавать вращение, но это были разные белки.
|
| 2-2. Белковый состав двух типов мембранных АТФ-синтаз (Mulkidjanian et al., «Biology Direct», 2008, 3, 13, doi:10.1186/1745-6150-3-13) |
У некоторых бактерий и архей мембранные АТФ-синтазы впускают в клетку не протоны, а ионы натрия. Соответственно комплексы дыхательной цепи у них тоже откачивают наружу натрий вместо протонов, жгутик вращается натриевым градиентом, и мембранные транспортеры тоже работают на натрии. Те обладатели натриевой энергетики, что были открыты первыми, обитают в экстремальных условиях — при высокой температуре или в сильнощелочной среде, и замена протонов на натрий выглядит хорошей адаптацией к этим условиям. Однако затем были открыты бактерии с натриевой энергетикой в самых разных экологических нишах, включая морскую воду и кишечник животных. Некоторые бактерии имеют и натриевую, и протонную АТФазу, два типа комплексов электрон-транспортной цепи и при смене условиях могут переключаться с натриевой энергетики на протонную и обратно.
На филогенетическом дереве АТФаз натрий-специфические ферменты занимают самые нижние ветви в обоих семействах — это говорит об их древности.
Второй аргумент в пользу древности натриевой энергетики — устройство ион-связывающих сайтов с-субъединиц. Каждый натриевый сайт образован пятью аминокислотами, атомы кислорода которых точно окружают ион натрия, заменяя молекулы воды в его гидратной оболочке. Протонные сайты же устроены очень по-разному и похожи на поврежденные мутациями варианты натриевого сайта («Biology Direct», 2008, 3, 13, doi: 10.1186/1745-6150-3-13).
Третий аргумент следует из происхождения АТРазы от системы секреции: ее мембранные с-субъединицы тоже связаны друг с другом ионами натрия.
Четвертый аргумент — состав мембранных липидов. Дело в том, что мембраны из липидов, описанных в начале, как у бактерий, так и у архей, не способны удерживать протонный градиент: протоны просачиваются через них, рассеивая энергию в тепло. Зато такие мембраны непроницаемы для ионов натрия. А чтобы мембраны задерживали протоны, бактерии и археи добавляют в них разные специальные липиды («Progress in Lipid Research», 2001, 40, 299–324. doi: 10.1016/S0163-7827(01)00009-1, «Advances in Microbial Physiology», 2005, 50, 227—259, doi: 10.1016/S0065-2911(05)50006-7).
Наиболее распространены у бактерий дополнительные липиды с разветвленными концами жирных кислот. У некоторых гипертермофилов, таких, как Bacillus acidocaldarius, на концах жирных кислот есть еще более объемные циклогексановые кольца. Многие группы алкалофильных (живущих в щелочных условиях) бактерий содержат в мембранах терпеновый углеводород сквален. Ацидофильные бактерии, живущие в среде с pH ниже 1, используют плоские циклические терпены — гопаноиды, отдаленно напоминающие стеролы эукариот. Наконец, у архей для создания протононепроницаемых мембран в дело идут дифтаниловые липиды — продукты восстановления двойных связей в обычных терпеновых липидах архей, кроме того, концы гидрофобных хвостов липидов двух сторон мембраны могут сшиваться (рис. 3).
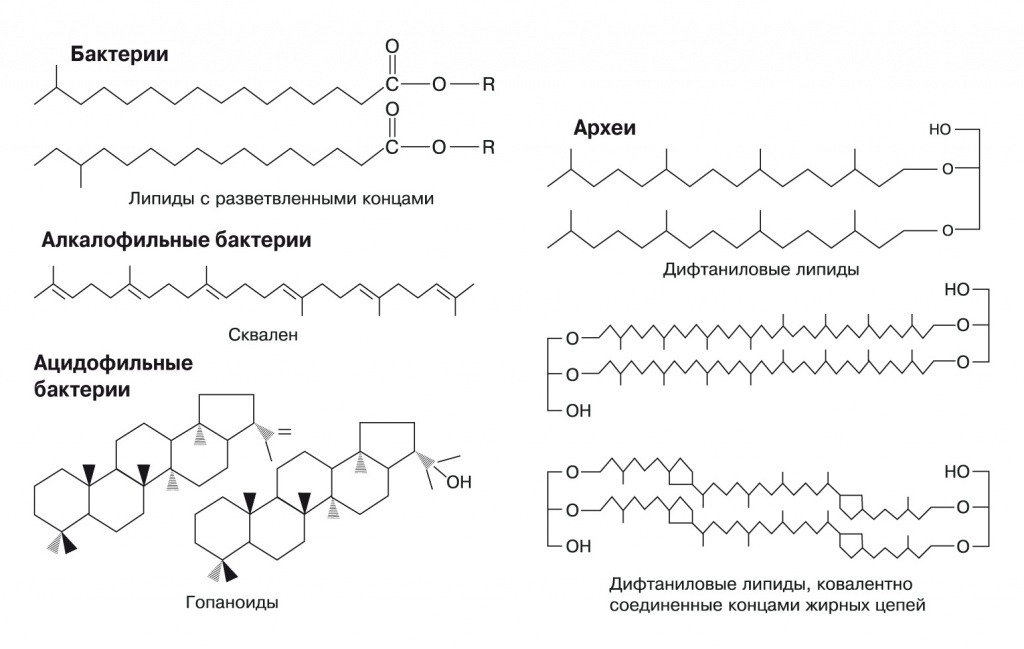
|
|
3. Некоторые протон-изолирующие компоненты в мембранах бактерий и архей. Еще больше экзотических липидов можно увидеть по ссылке http://aem.asm.org/content/73/19/6181/F1.expansion.html
|
Таким образом, естественно предположить, что сначала у прокариот существовали более простые по составу мембраны, не пропускающие натрий, а протононепроницаемость возникла позже. Однако протонный энергетический цикл имеет важное преимущество по сравнению с натриевым: перенос протонов через мембрану легко сопрягается почти с любой окислительно-восстановительной реакцией. Протон-движущие комплексы электрон-транспортной цепи гораздо разнообразнее, чем натриевые. Например, натриевые электрон-транспортные цепи не работают с молекулярным кислородом. Зато существуют не окислительно-восстановительные натриевые насосы, например пирофосфатазные и декарбоксилазные, что означает возможность мембранной энергетики без электрон-траспортных цепей.
Подводим итоги (рис. 4): общий предок бактерий и архей имел примитивные мембраны, вероятнее всего — с однохвостыми липидами из терпенового спирта и полярной головки, без глицерина. Эти мембраны пропускали протоны и ионы металлов, но задерживали белки и РНК, поэтому для управляемого выделения белков во внешнюю среду возникли системы секреции. После разделения линий бактерий и архей у тех и других независимо появились мембраны из липидов с двумя гидрофобными хвостами, непроницаемые для ионов металлов. Выход из исходных геотермальных местообитаний в моря, с их высокой концентрацией натрия, потребовал создания систем откачки натрия из клеток. Так появились натриевые насосы, использующие энергию разных химических реакций. Затем в системе секреции белка застрял секретируемый продукт, превратив ее в Na-движущую АТФ-синтазу, и создаваемый химическими насосами натриевый градиент стал частично расходоваться на синтез АТФ. Это независимо произошло в линиях бактерий и архей.
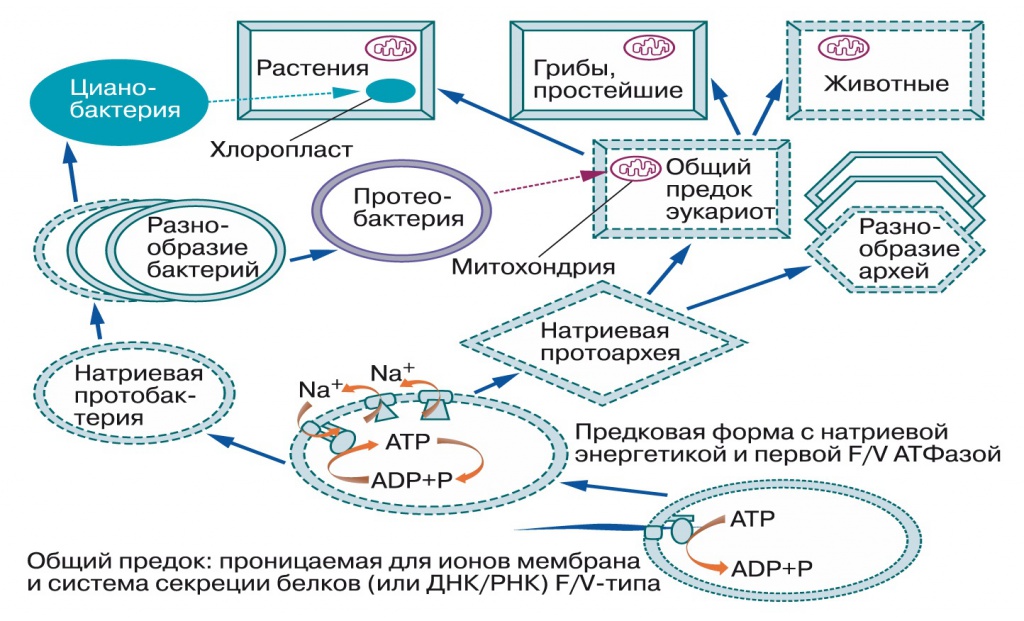
|
| 4. Схема эволюции мембран и мембранной энергетики (Mulkidjanian et al., Biol. Direct», 2008, 3, 13, doi: 10.1186/1745-6150-3-13). Сплошными линиями показаны мембраны, непроницаемые для протонов, пунктирами — непроницаемые для натрия, точечной линией — проницаемая для всех ионов металлов и протонов мембрана общего предка |
Далее, по мере освоения сильнокислых местообитаний, появились протононепроницаемые мембраны, а мутация Na-АТФ-синтазы превратила ее в протонную. Это позволило использовать ее для откачки лишних протонов из клетки за счет энергии АТФ. Другие прокариоты для той же цели — откачки лишних протонов — приспособили комплексы дыхательной цепи. После этого горизонтальный перенос генов свел в одной клетке протон-движущие комплексы дыхательной цепи и протон-движущую АТФазу. Комплексы дыхательной цепи создавали более высокую разность потенциалов, поэтому протонная АТФаза заработала в обратном направлении — стала синтезировать АТФ (если взять два разных электрических генератора и соединить их проводами, тот из них, который давал меньшее напряжение, станет работать электродвигателем). Наконец, протонная энергетика благодаря разнообразию используемых окислительно-восстановительных реакций в значительной степени вытеснила натриевую, что мы и наблюдаем в современном мире.
Элементы жизни: почему не кремний и не фтор
Фотохимия и «черные курильщики»
Пути восстановления углекислого газа
Происхождение белкового синтеза и генетического кода
Мир вирусов, последний общий предок и происхождение ДНК
Происхождение мембран и мембранной биоэнергетики
Закат «цинкового мира», прокариотная биосфера и происхождение фотосинтеза
Роль вирусов в происхождении клеточного ядра
