Механизм нуклеофильного замещения нуждается в пересмотре?
 |
|
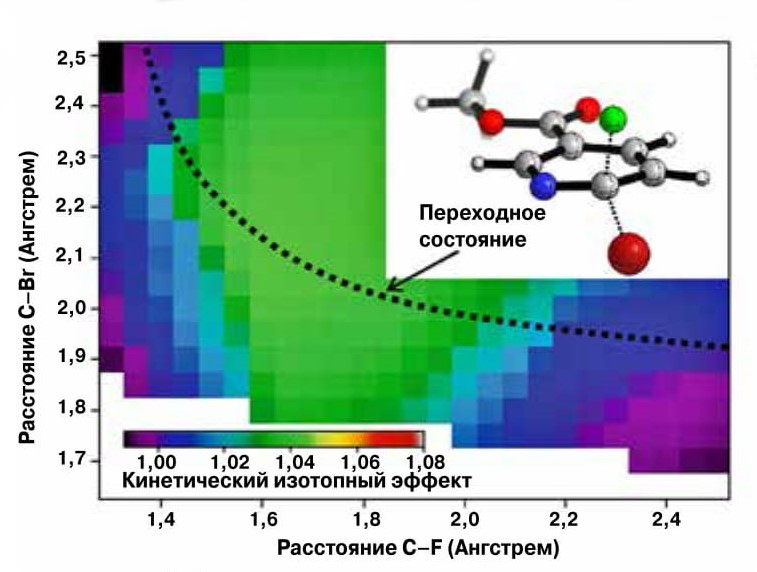
Предсказанные на основании квантово-химических расчетов значения кинетического изотопного эффекта реакции замещения. Координата реакции, протекающей по наиболее выгодному с точки зрения энергии согласованному механизму, отмечена черным пунктиром. Предсказанные значения КИЭ согласуются с измеренными в ходе эксперимента значениями. |
Результаты, полученные исследователями из США, позволяют предположить, что классический механизм нуклеофильного ароматического замещения (SNAr), который приводится в вузовских учебниках по органической химии, нельзя применять для большинства реакций. Интермедиат процесса замещения, описываемый в учебниках, — скорее исключение, чем правило («Nature Chemistry», 2018, doi: 10.1038/s41557-018-0079-7).
Нуклеофильное ароматическое замещение SNAr — процесс, часто применяемый для синтеза фармакологически активных соединений. В учебниках об этом замещении говорится как о двухстадийном процессе, в ходе которого образуется отрицательно заряженный интермедиат — комплекс Мейзенгеймера. Как отмечает руководитель исследования Эрик Якобсен из Гарварда, хотя в последнее время накапливаются свидетельства в пользу того, что представления о «пошаговом» двухстадийном замещении не всегда соответствуют данным эксперимента, большинство преподавателей и исследователей эти свидетельства игнорируют. По мнению Якобсена, такой консерватизм может объясняться как тем, что «механизм из учебника» проще понять, так и тем, что не всегда удается соотнести основанные на результатах квантово-химических расчетов предсказания и результаты эксперимента.
Исследователи из группы Якобсена провели и экспериментальное, и теоретическое исследование нуклеофильного ароматического замещения. Для экспериментов отобрали три соединения, заместители которых должны были стабилизировать или дестабилизировать комплекс Мейзенгеймера. Экспериментально образование такого комплекса было подтверждено только в случае, предельно подходящем для его стабилизации, — в реакции динитрофтормензола с метилат-анионом (в ароматическом соединении две нитрогруппы способствуют понижению электронной плотности на бензольном кольце, а метилат-анион — очень сильный нуклеофил). Компьютерное же исследование 120 реакций SNAr говорит о том, что в 83% случаев замещение протекает в одну стадию в результате согласованного процесса.
Ключом для изучения механизма и сравнения результатов теоретического и экспериментального исследования были измерения кинетического изотопного эффекта (КИЭ). Суть его, если говорить схематично в применении к обсуждаемому исследованию, заключается в том, что скорости реакции с участием связей 12С–F и 13С–F должны различаться, только если разрыв этих химических связей происходит на определяющей скорость (то есть самой медленной) стадии механизма реакции. Якобсен с коллегами определил величины КИЭ нескольких реакций квантово-химически, измерил эти величины экспериментально с помощью спектроскопии ЯМР на ядрах фтора, и оказалось, что измеренные величины близки предсказанным для согласованного механизма замещения, а не для процесса, протекающего с образованием комплекса Мейзенгеймера.
Критики работы Якобсена говорят о том, что эксперимент проводили в метаноле либо в диметилформамиде, проигнорировав более полярные и протонодонорные растворители, которые, по логике вещей, могли бы стабилизировать комплекс Мейзенгеймера. Однако Якобсен отвечает, что смоделированный квантово-химически учет влияния даже такого полярного растворителя, как вода, не меняет координату реакции, и фактически двухстадийное замещение остается выгодным лишь в 17% случаев, которые определяются не условиями среды реакции, а только реагентами.
У кого-то может возникнуть вопрос: зачем изучать механизмы реакций? Конечно же не для того, чтобы опровергать учебники. Чем больше мы знаем о механизме реакции, тем больше шансов, что мы будем ею «правильно» управлять, осуществив важные превращения в наиболее подходящих условиях.
Эта статья доступна в печатном номере "Химии и жизни" (№ 9/2018) на с. 16 — 17.
