Легкое дыхание
Нобелевская премия 2019 года по физиологии или медицине присуждена Уильяму Кэлину-младшему (Гарвардская медицинская школа, Медицинский институт Говарда Хьюза, США), сэру Питеру Рэтклифу (Оксфордский университет, Институт Фрэнсиса Крика, Великобритания) и Грегу Семенце (Университет Джонса Хопкинса, США) за открытия в области чувствительности и адаптации живой клетки к изменениям концентрации кислорода.
Когда-то, давным-давно — скажем, три миллиарда лет назад, — земная жизнь прекрасно обходилась без кислорода. Да и зачем он нужен, этот универсальный окислитель, убийца биомолекул. Однако примерно 2,4 млрд лет назад на Земле произошла экологическая катастрофа («Химия и жизнь», 2016, 9). Формы жизни, практикующие фотосинтез, в качестве отхода производства углеводов из углекислого газа начали выделять О2 и чудовищно загрязнили им атмосферу. Первым заметным следствием этого события стало массовое вымирание древних организмов, вторым — появление форм, ставших нашими далекими предками. Есть обоснованное мнение, что именно благодаря росту концентрации кислорода возникла эукариотическая клетка с ядром и митохондриями, и в конечном счете многоклеточные формы жизни. Так что теперь эту катастрофу чаще называют Великой кислородной революцией — историю, как известно, пишут победители.
Эукариотическая клетка научилась использовать вредный окислитель, выделяемый зелеными растениями, для получения энергии — куда большего количества энергии, чем можно добыть другими способами. (Так гораздо позднее наши предки поставили себе на службу самую опасную стихию, огонь.) Кислород стал синонимом жизни: все понимают, что «перекрыть кислород» — это очень плохо, а «глоток кислорода» — наоборот, хорошо. Вредным окислителем он быть не перестал, и у каждой клетки имеются в наличии «противопожарные» средства для борьбы с активными формами кислорода, всякими радикалами и перекисями.
Но отсутствие кислорода для нас куда опаснее его присутствия. Детекторы нашего организма отслеживают концентрации кислорода и углекислого газа во внутренней среде не менее бдительно, чем сотрудники АЭС — показания приборов или участники торгов на бирже — курс важных акций: это вопрос жизни и смерти. И если концентрации подходят к красной черте, включаются разнообразные аварийные системы.
Никто не напоминает себе дышать интенсивнее во время пробежки, когда мышцы расходуют много энергии и насыщают кровь углекислым газом, или в разреженном горном воздухе, или когда мы выныриваем из воды, — это получается «само». Кавычки стоят потому, что в действительности за это отвечают нейроны дыхательного центра, которые получают информацию от хеморецепторов O2и CO2. Кстати, именно дыхательный центр запускает то, что традиционно считается началом человеческой жизни: первый наш самостоятельный вдох (и выдох, обычно с криком), когда после отрезания пуповины в крови растет концентрация углекислого газа. При дефиците кислорода в отдельно взятой ткани, например в той же активно работающей мышце, ее клетки могут перейти на анаэробный (бескислородный) тип метаболизма; его продукт — та самая молочная кислота, из-за которой после тренировки болят ноги и руки.
Помимо физиологического и биохимического уровней регуляции есть и клеточный. Когда человек с равнины попадает в горы, где парциальное давление кислорода в воздухе низкое, снижение уровня кислорода в крови воспринимают специальные клетки почек. Почки, в свою очередь, производят гормон эритропоэтин, который включает эритропоэз — производство эритроцитов в костном мозгу. Если в крови больше эритроцитов, они лучше справляются с доставкой кислорода (это и есть та самая причина, по которой эритропоэтин нелегально применяется как допинг). Связующие звенья молекулярной цепочки между кислородом в крови и гормоном эритропоэза обнаружили нобелевские лауреаты 2019 года.
Еще в конце 80-х, когда клонирование ДНК было передним краем науки, Грег Семенца и Питер Рэтклиф с коллегами независимо друг от друга установили, что определенный участок ДНК рядом с геном эритропоэтина EPO необходим для того, чтобы гипоксия запустила производство эритропоэтина. Этот участок Семенца назвал «элемент ответа на гипоксию» — hypoxia response element, HRE. Белок, который взаимодействовал с этим участком и появлялся в клетке при нехватке кислорода, без особых затей назвали «фактор, индуцируемый гипоксией» — hypoxia inducible factor, HIF). Он-то и включает ген эритропоэтина. Да, это очередная история о регуляции в эукариотической клетке — «внучка за бабку, бабка за дедку, дедка за репку…» — однако не такая длинная, как некоторые, и с довольно остроумной концовкой.
И Рэтклиф, и Семенца убедились в том, что HRE исправно работает в самых разных типах клеток: если эти клетки растут при недостатке кислорода, HRE активирует зависимый от него ген. Кстати, этим геном может быть не только EPO, есть и другие гены, регулируемые гипоксией по тому же механизму, через такой же регуляторный участок. Продукты их способствуют выживанию при низком содержании кислорода: ферменты бескислородного производства энергии (гликолиза), фактор роста эндотелия сосудов VEGF — чем больше сосудов в ткани, тем лучше она снабжается кислородом… Все это говорило о том, что изучаемый механизм универсален, а не предназначен, скажем, только для клеток почек, и роль его куда важнее, чем представлялось изначально. Интерес научного сообщества к HRE и HIF начал расти.
Семенце с соавторами удалось очистить HIF, определить аминокислотную последовательность и получить соответствующую ей комплементарную ДНК. Оказалось, что HIF, в свою очередь, состоит из двух белков: HIF-1α, чувствительного к кислороду, и второго, уже описанного ранее ARNT. Были открыты и другие белки, сходные с HIF-1α и функционально подобные ему.
Теперь мы знаем, что задачи HIF-1α не исчерпываются адаптацией к гипоксии. Например, он экспрессируется в стволовых клетках — предшественниках клеток крови и замедляет в них метаболизм, способствуя их «вечной молодости». Он играет важную роль в дифференцировке клеток и развитии организма, в частности при формировании сосудистой системы. Он необходим для выживания хондроцитов — клеток хряща, не самой богатой кислородом ткани. Делеция генов этого белка у млекопитающих ведет к смерти плода на поздних стадиях беременности или новорожденного.
Но остается еще одна часть истории: как наш выключатель переводится в положение «выкл»? Если кислорода достаточно, организму больше не нужно увеличивать количество эритроцитов и не нужен гормон эритропоэтин — как сказать «горшочек, не вари», куда девать HIF?
Было известно, что уровень HIF-1α регулируется не снижением активности гена или синтеза белка, а ускорением его распада: когда белок не нужен, его быстро расщепляют. Также удалось показать, что деградирует он обычным путем: к нему пришивают «черную метку» — молекулу убиквитина, которая означает для клетки, что данный белок свое отработал и его можно демонтировать. Не совсем обыкновенным, но логичным было то, что этот процесс зависел от присутствия кислорода.
Группа Кэлина в 1995 году опубликовала полную последовательность гена, кодирующего VHL — белок-онкосупрессор, подавляющий рост опухолей; мутации в гене таких белков приводят к онкологическим заболеваниям. То, что это именно онкосупрессор, как раз и установила группа Кэлина, а в 1996 году они показали также, что многие гены-мишени HIF активнее экспрессируются в клетках с мутантным геном белка VHL. Потом выяснилось (при участии Рэтклиффа с коллегами), что VHL вовлечен в убиквитинилирование HIF-1α, но только при нормальном содержании кислорода в среде.
 |
|
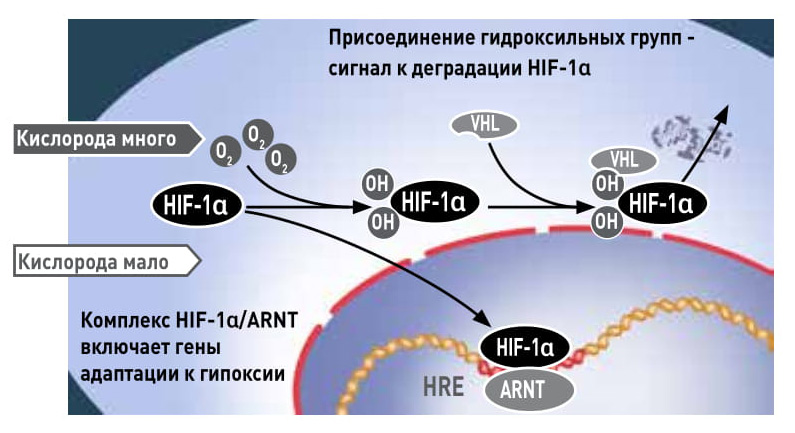
Что узнали нобелевские лауреаты о том, как клетка приспосабливается к низкому уровню кислорода. Когда он низкий, HIF-1α защищен от деградации и накапливается в ядре, где связывается с ARNT и взаимодействует с участками HRE, активируя все гены, необходимые для адаптации к гипоксии. При нормальном уровне кислорода к HIF-1α добавляются ОН-группы, а когда он гидроксилирован, с ним легко взаимодействует белок VHL и подает сигнал к его расщеплению — гены адаптации кислорода оказываются выключенными |
Как именно система узнает о повышении концентрации кислорода? Оказалось — очень изящным способом. В присутствии кислорода специальный фермент присоединяет ОН-группы к двум остаткам аминокислоты пролина в составе HIF-1α, тем самым увеличивает его способность связываться с VHL и направляет на путь разрушения (это установили также Рэтклиф и Кэлин). Есть кислород — нет HIF, эритропоэз замедляется. Нет кислорода — VHL не распознает HIF, и тот выполняет свою функцию. (На самом деле у перестраховщицы природы есть еще запасной механизм, при котором гидроксильные группы пришиваются к другой аминокислоте HIF-1α, и он не деградирует, а просто теряет активность.)
История на этом не оканчивается — например, совсем недавно вышли статьи, в том числе и группы Кэлина, о том, как гипоксия регулирует метилирование белков-гистонов, на которые намотана ДНК, то есть еще и таким, эпигенетическим путем влияет на экспрессию генов. (HIF в этом, по-видимому, не участвует.)
И конечно, практическое применение открытия еще впереди. Ферменты, присоединяющие ОН-группы к HIF-1α — пролингидроксилазы, — стали перспективной мишенью для фармакологии: вещество, которое сможет прицельно отключать эти ферменты, очевидно, может стать лекарством от анемии, и такие лекарства уже проходят клинические испытания. HIF важен для функционирования иммунной системы, формирования сосудов и хрящей, заживления ран, восстановления нервной системы после повреждений; воздействие на него может быть полезным при онкологических заболеваниях, в том числе вызванных мутациями в гене VHL.
Ну а если мы помечтаем об освоении Марса и выживании человека в бедной кислородом атмосфере — в аптечку колониста надо будет включить ингибитор пролингидроксилаз или HIF-1α, упакованный в наночастицы. Если только удастся решить все остальные проблемы колонизации, на Марсе лауреатам Нобелевской премии 2019 года непременно поставят памятник.
