Электронный микроскоп, точный расчет и холодный образец
Лауреатами Нобелевской премии по химии за 2017 год стали Жак Дюбоше (Университет Лозанны, Швейцария), Йоахим Франк (Колумбийский университет, Нью-Йорк, США) и Ричард Хендерсон (Кембридж, Великобритания). Награду они получили за «разработку методов криоэлектронной микроскопии высокого разрешения, позволяющих определить структуру биомолекул в растворе». Пресс-релиз Нобелевского комитета поясняет, что метод криоэлектронной микроскопии открыл новую эру в биохимии и помог заполнить множество пробелов в наших знаниях о молекулах жизни.
Некоторые интернет-ресурсы в день объявления лауреатов отреагировали на новость броскими заголовками, например: «Нобелевскую премию по химии дали за мгновенную заморозку биологических образцов». Так что же самое важное в криоэлектронной микроскопии: процесс заморозки, адаптация электронной микроскопии к нуждам биохимии, сочетание методов или что-то другое?
Начало большого пути
В 1968 году была опубликована заключительная часть научно-популярной трилогии Георгия Гамова «Мистер Томпкинс в стране чудес». Она была написана в соавторстве с микробиологом Мартынасом Ичасом и называлась «Мистер Томпкинс внутри самого себя. Приключения в новой биологии». В книге рассказывалось о том, как мистер Томпкинс в сопровождении семейного врача изучает клеточное строение своего тела и плавает по своим кровеносным сосудам. Рассказывая о деталях строения клеток, экскурсовод пояснял Томпкинсу, что вся эта информация получена с помощью электронного микроскопа. Читателям становилось очевидным, что электронная микроскопия уже позволяет изучать биологические ткани и отдельные клетки, получать изображения биологических объектов с невиданной четкостью и деталировкой. На самом деле еще лет десять назад ученым оставалось только мечтать об использовании электронного микроскопа для изучения атомно-молекулярной архитектуры биологически активных молекул (ведь они все-таки существенно меньше клеток).
 |
|
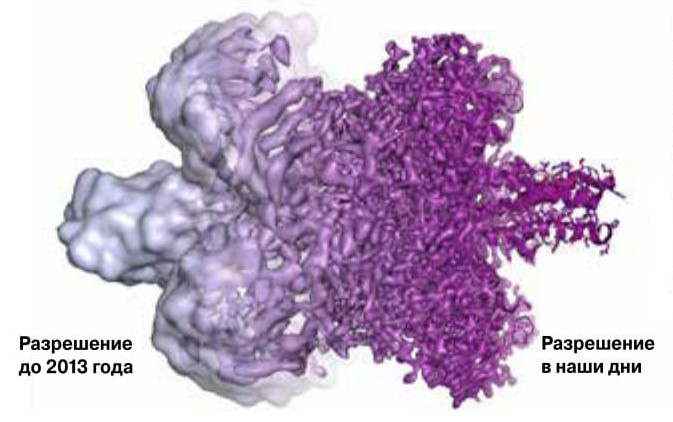
1. На примере молекулы фермента глутаматдегидрогеназы показано, как улучшалось разрешение методов криоэлектронной микроскопии. Сегодня она дает возможность изучать биологические объекты в атомном разрешении (ленточная структура белка на крайнем правом фрагменте рисунка).
|
Мечта сбылась совсем недавно, спустя четыре десятка лет после углубления мистера Томпкинса в самого себя, и это в значительной мере заслуга Жака Дюбоше, Йоахима Франка и Ричарда Хендерсона. Благодаря их открытиям мы можем исследовать все детали структуры биомолекул непосредственно в растворе (рис. 1).
Путь электронной микроскопии в биохимию не был усыпан розами. Вскоре после того, как в 1931 году Эрнст Август Фридрих Руска продемонстрировал принцип работы электронного микроскопа — это принесло ему Нобелевскую премию по физике 1986 года, — венгерский физик Ладислав Мартон написал статью, в которой утверждал, что шансы применения ЭМ-микроскопии для изучения биоматериалов равны нулю, поскольку «интенсивная бомбардировка живых клеток электронами приведет к их разрушению» («Nature», 1934, 133, 911—911, doi: 10.1038/133911b0).
Не исключено, что именно благодаря Мартону перед Дюбоше, Франком и Хендерсоном встала сложная, но, согласитесь, приятная задача — подготовка нобелевских лекций. В том самом письме 1934 года в редакцию «Nature» Мартон предложил возможные методы адаптации электронной микроскопии для исследования биологических объектов — заморозка либо метод, напоминающий негативное контрастирование. Разумеется, в то время подобные подходы были чистым теоретизированием.
Решения еще одной проблемы Мартон не увидел: в рабочей камере электронного микроскопа из биологического образца испаряется вода и вследствие этого изменяется структура белков и нуклеиновых кислот. Очевидны были и другие проблемы: биологические объекты могли иметь крайне низкую контрастность при прохождении через них электронов с высокой энергией; энергию электронного пучка нельзя было делать очень высокой также из-за опасности повредить биомолекулу на химическом уровне; чтобы избежать вторичного рассеивания электронов, нужны не просто тонкие образцы, а идеальный монослой изучаемых объектов. Кроме того, было ясно, что для записи изображений необходимы быстрые детекторы — биомолекулы способны менять форму или даже перемещаться из-за незначительного дрейфа температуры или взаимодействия с бомбардирующими их электронами.
Усилить сигнал и расшифровать
Во всяком случае, было понятно, что для изучения низкоконтрастных биоматериалов нужны электроны, обладающие как можно меньшей энергией, — именно это стимулировало поиск новых подходов к подготовке образцов. Первым шагом к существенному увеличению качества изображения был метод негативного контрастирования, разработанный в 1940-х годах и модифицированный в последующие два десятка лет («Journal of Applied Physics», 1945, 16, 459—465; doi: 10.1063/1.1707615. «Journal of Molecular Biology», 1965, 11, 403—423; doi: 10.1016/S0006-3495(89)82799-7). Метод основан на том, что биологический материал внедряют в тонкую аморфную пленку соли тяжелого металла (например, фосфата вольфрама), формирующую шаблон вокруг биомолекул (в точном соответствии с их формой). Этот шаблон рассеивает даже обладающие низкой энергией электроны лучше, чем находящийся внутри него биологический материал, он меньше повреждается потоком электронов и не дает биологическим молекулам менять форму во время их вакуумной сушки.
Негативное контрастирование образцов позволило получить детальную информацию о строении бактерий, вирусов и клеточных органоидов. Однако для более мелких объектов, например молекулярных комплексов, можно было получить в лучшем случае изображение «конверта», в который помещены биомолекулы (разрешение ограничено величиной зерна шаблона). И все же это был шаг вперед.
Вклад в адаптацию методов электронной микроскопии для биологических объектов внес в том числе и Аарон Клуг, получивший в 1982 году Нобелевскую премию по химии «за разработку метода кристаллографической электронной микроскопии и прояснение структуры биологически важных комплексов нуклеиновая кислота — белок». Он одним из первых пришел к тому, что для уточнения трехмерной структуры объекта, полученной с помощью метода негативного контрастирования, нужно сопоставить его двумерные проекции с различных сторон — это можно сделать, изменяя угол, под которым на образец направляется поток электронов. В 1960-х годах Клуг изучил таким образом тонкие кристаллы каталазы («Berichte der Bunsengesellschaft für physikalische Chemie», 1970, 74, 1129—1137; doi: 10.1002/bb pc.19700741109).
В 1968 году Клуг совместно с Давидом Дерозье сообщили о первом удачном примере: они вычислили трехмерную модель биологического объекта, исходя из двумерных проекций, полученных с помощью электронного микроскопа. Исследователи изучили хвост бактериофага T4 — его выбрали из-за спиралевидной симметрии, то есть для него трехмерную модель можно было построить, анализируя лишь одну двумерную проекцию, поскольку она одинакова под любыми углами («Nature», 1968, 217, 130-134; doi: 10.1038/217130a0).
Чтобы получить информацию о трехмерной структуре частиц, не обладающих спиралевидной симметрией, нужны комбинированные данные от нескольких двумерных проекций этих частиц. В 1970 году Клуг с Дерозье и Энтони Краутером разработали «подход общих линий», с помощью которого определили трехмерную структуру икосаэдрических капсидов вирусов («Proceedings of the Royal Society of London», 1970, A 317, 319—340; doi: 10.1098/rspa.1970.0119). В работе предполагалось, что аналогичный метод можно применить к несимметричным частицам, но все-таки более точные результаты он дает при анализе симметричных образцов.
Наблюдение не должно изменять объект
Еще один шаг к применению электронной микроскопии в биохимии был сделан, когда удалось сохранить в камере электронного микроскопа гидратированное состояние биомолекулы, а также сам анализируемый объект в целости и сохранности. Для этого Дональд Парсонс разработал конструкцию камер, в которых поддерживались определенная влажность и комнатная температура («Science», 1974, 186, 407—414; doi: 10.1126/science.186.4162.407). В этих камерах он исследовал кристаллы фермента каталазы и нашел условия, при которых облучение электронами не влияет на строение белка.
В 1970-е годы Роберт Глэзер смог количественно оценить степень повреждения кристаллической каталазы и низкомолекулярных органических соединений при облучении потоком электронов. Он пришел к выводу, что энергия излучения, способная повредить небольшое количество изучаемых объектов, равномерно распределится между большим количеством биомолекул одного и того же типа («Journal of Molecular Biology», 1975, 94, 425—432; doi: 10.1016/0022-2836(75)90212-0). Был еще один способ, который мог одновременно понизить скорость испарения воды и защитить биологический материал от повреждения электронным пучком, — охлаждение объекта. В 1950—1960-х годах Умберто Моран изучал возможности заморозки образцов и приготовления чрезвычайно тонких препаратов для крио-электронной микроскопии («Annals of the New York Academy of Sciences», 1960, 85, 689—713; doi: 10.1111/j.1749-6632.1960.tb49990.x). Однако вода обычно замерзает с образованием мельчайших кристалликов льда, на которых происходит дифракция электронов, а это сильно искажает сигналы, не говоря уже о том, что кристаллики могут изменить строение объекта. Базиль Люэ предложил снизить негативное влияние холода на биологические образцы, ускорив заморозку, — при этом вода затвердевает, формируя не кристаллическую, а аморфную твердую структуру. В 1960-е годы быструю заморозку применили для изучения белков с помощью рентгеноструктурного анализа. Образованию ледяных кристалликов также препятствует добавление в образец антифризов — сахарозы или глицерина («Acta Crystallographica B», 1970, 26, 998—1004; doi: 10.1107/S0567740870003485).
Чуть позже Глэзер и Кеннет Тейлор показали, что при быстрой заморозке можно с помощью электронной микроскопии рассмотреть кристаллы каталазы и получить картинку с разрешением в 3Å, не используя контрастирование. Доступная в то время технология заморозки позволяла проводить исследования при температуре выше –120оC — при этой температуре аморфный лед должен превращаться в кристаллический. Тем не менее в условиях эксперимента кристаллики льда не образовывались — как предположили исследователи, из-за того, что вода взаимодействует с поверхностью белка («Nature», 271, 1978, 659—660; doi: 10.1038/271659a0). Тейлор и Глэзер также придумали, как хранить биологические образцы при низких температурах, и доказали, что охлаждение образца увеличивает его информационную емкость.
После этого развитие методов, позволяющих изучать биомолекулы с помощью электронной микроскопии, на какое-то время прекратилось — до 1990-х годов существенных модификаций не было.
Нобелевские лауреаты 2017 года
 |
| 2. Атомная модель бактериородопсина — трехмерная карта электронной плотности, наложенная на «срез». Информация получена с помощью криоэлектронной микроскопии |
Однако человек устроен так, что ему всегда хочется большего. Начало 1990-х годов вполне можно считать вехой в развитии криоэлектронной микроскопии — Ричард Хендерсон с коллегами впервые продемонстрировал, что с ее помощью можно получить высококачественные изображения биологического объекта, совмещая и усредняя его разные изображения (рис. 2).
В своей первой работе Хендерсон получил качественную информацию о строении бактериородопсина, используя результаты сразу с нескольких электронных микроскопов, находящихся в различных научных центрах. При этом он оптимизировал информацию, полученную с каждого устройства («Journal of Molecular Biology», 1990, 213, 899—929; doi: 10.1016/S0022-2836(05)80271-2). В процессе обнаружился ряд технических ограничений, свойственных этим микроскопам, а также проблемы, связанные с приготовлением образцов. Хендерсон сделал вывод, что устройство электронных микроскопов и подготовку образцов надо принципиально изменить и тогда криоэлектронная микроскопия превратится в рутинный метод определения строения биологических препаратов. С его помощью можно будет изучать в том числе ассоциаты биомолекул, не обладающие кристаллической и симметричной структурой. Главная проблема исследования асимметричных частиц, которые располагаются без формирования дальнего порядка, в том, что трудно уловить слабый сигнал, который такая частица генерирует (измеряется соотношение сигнал-шум), и соответственно определить положение и ориентацию частицы в образце. Однако компьютерная техника, доступная исследователям в 1990 году, и не могла решить такую задачу («Journal of Structural Biology», 1999, 128, 3—14; doi: 10.1006/jsbi.1999.4172). В последующее десятилетие методы, подобные тем, что применил Хендерсон, использовали и другие группы ученых, они получили в том числе качественные изображения светопоглощающего комплекса хлорофилл-белок, тубулинового димера и аквапорина.
 |
|
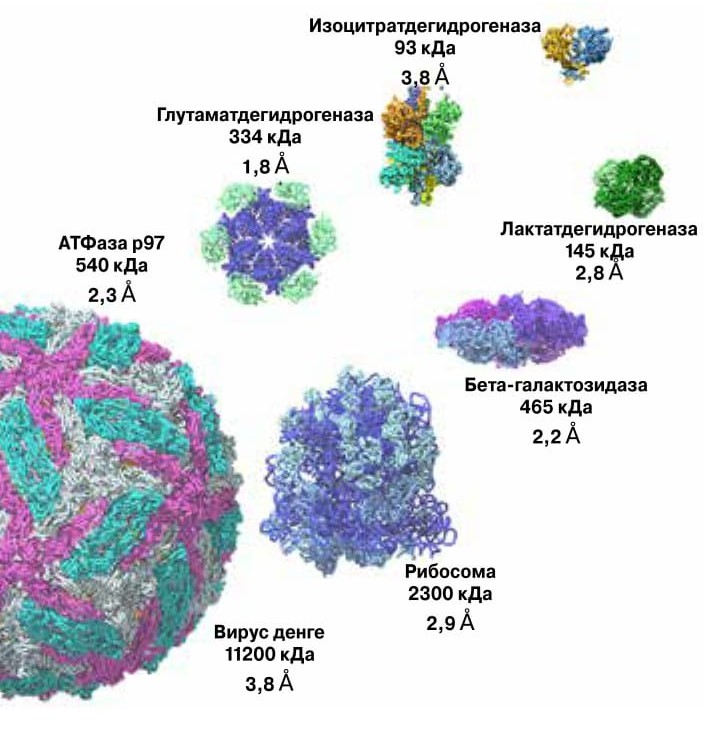
Примеры структур биологически активных соединений, изученных с помощью криоэлектронной микроскопии к маю 2016 года («Cell», 2016, 165, 1698—1707; doi: 10.1016/j.cell.2016.05.040) |
Через пять лет после выхода статьи про структуру бактерио-родопсина Хендерсон представил детальный анализ задач, который требовалось решить для того, чтобы получать с высоким разрешением картинки ассоциатов биологически активных молекул, не формирующих кристаллические структуры («Quarterly Reviews of Biophysics», 1995, 28, 171—193; doi: 10.1017/S003358350000305X). Он сделал вывод, что нужно применять малоинтенсивное недеструктивное облучение электронами и использовать фазовый контраст, — это позволит определить двумерное положение индивидуальных частиц в плоскости двумерного кристалла и их трехмерную ориентацию. Правда, только в том случае, если частицы обладают достаточной молекулярной массой. Хендерсон считал, что для биомолекул и ассоциатов биомолекул с молекулярной массой больше 50 килодальтон можно получить образец с достаточным количеством частиц (около 10 000) и определить их строение с помощью электронной микроскопии с атомным разрешением ~3 Å. К началу XXI века Глэзер пришел к выводу, что минимальное значение молекулярной массы объекта, который можно проанализировать с разрешением в три ангстрема, — 20 килодальтон («Journal of Structural Biology», 1999, 128, 3—14; doi: 10.1006/jsbi.1999.4172). Правда, биомолекулы с такой молекулярной массой пока еще никому не удалось изучить, а самая легкая молекула, строение которой помог установить электронный микроскоп, — гемоглобин, 64 кДа («Nature Communications», 2017, 8, 16099; doi: 10.1038/ncomms16099). Но все-таки разрешение, с которым удается рассмотреть строение некоторых молекул, уже меньше 2 Å (рис. 3).
Второй нобелевский лауреат 2017 года, Йоахим Франк, еще в середине 1970-х годов стал заниматься фундаментальной проблемой изучения неконтрастированных, некристаллических асимметричных частиц, случайным образом ориентированных в растворе («Ultramicroscopy», 1975, 1, 159—162; doi: 10.1016/S0304-3991(75)80020-9). Франк полагал, что надо «создать условия для усиления тех признаков частиц, сигналы которых могут быть четко различимы на фоне значительных шумов».
В 1977 году Франк с коллегами описал, как обеспечить такое усиление — взаимной корреляцией сигналов от различных частиц («Ultramicroscopy», 1977, 2, 219—227; doi: 10.1016/S0304-3991(76)91385-1). Неупорядоченное расположение частиц можно определить с помощью пучков электронов, мощность которых недостаточна для разрушения объектов, и потом выстроить изображение с высоким разрешением, усреднив сигналы от каждой частицы. Решение было правильным, что и продемонстрировали при изучении строения фермента глутаминсинтетазы («Ultramicroscopy», 1978, 3, 283—290; doi: 10.1016/S0304-3991(78)80038-2).
В идеале для некристаллических образцов, состоящих из одинаковых частиц, требуется не так уж много информации, описывающей их положение в условной плоскости и ориентацию в трехмерном пространстве, — чтобы решить такую математическую задачу, требуется определить всего пять параметров. Однако реальные биологические системы отличаются от идеализированной математической модели тем, что образующие их частицы редко бывают совершенно одинаковыми и часто содержат примеси. Поэтому приходится создавать уточненные математические модели, которые учитывают неоднородность изучаемой системы, и создавать алгоритмы, сортирующие результаты исследования объекта и учитывающие, какие сигналы можно использовать далее для построения усредненной картины, а от каких следует избавиться. В 1981 году Франк с коллегами описал метод, позволяющий сортировать образы частиц на основании их ориентации в пространстве и особенностей строения («Ultramicroscopy», 1981, 6, 187—194; doi: 10.1016/03043991(81)90059-0). В этом же году он обобщил математические модели в компьютерной программе SPIDER (System for Processing Image Data from Electron microscopy and Related fields — система для обработки данных электронной микроскопии и связанных областей, «Ultramicroscopy», 1981, 6, 343—357; doi: 10.1016/S0304-3991(81)80236-7). Этот программный пакет для обработки изображений, полученных с помощью электронной микроскопии, существует и обновляется до сих пор (https://spider.wadsworth.org/spider_doc/spider/docs/spider.html). Более того — программы бесплатные, что, безусловно, облегчает работу ученых во всем мире.
Как уже упоминалось, ученые ожидали, что быстрое охлаждение образца избавит электронную микроскопию от многих ограничений и позволит применять ее к биомолекулам. Проблему ледяных кристалликов планировали преодолеть с помощью быстрой заморозки, однако до 1980-х годов принципиальная возможность получения твердой стеклообразной воды была под вопросом — ученые думали, что необходимая для этого скорость охлаждения никогда не будет достигнута.
В 1980 году дискуссии на эту тему закрыли — исследователям удалось заморозить микрометровые капли воды, переведя ее в стеклообразное состояние («Nature», 1980, 288, 569—571; doi: 10.1038/288569a0). Годом позже Жак Дюбоше и Аласдер Макдауэлл получили тонкую пленку твердой некристаллической воды. Биообъекты, замороженные в такой пленке, можно будет изучать с помощью электронной микроскопии («Journal of Microscopy», 1981, 124, 3—4; doi: 10.1111/j.1365-2818.1981.tb02483.x).
 |
|
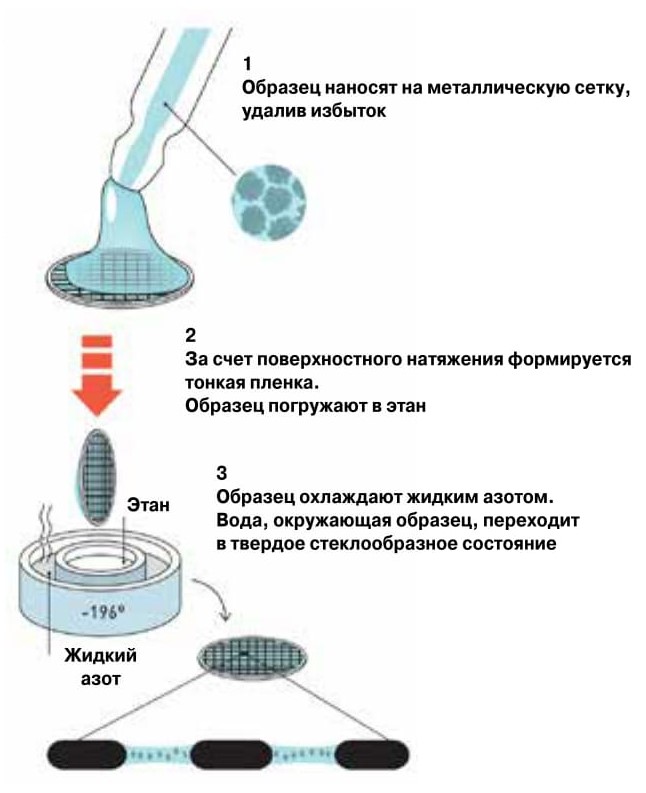
Методика приготовления образца для криоэлектронной микроскопии
|
Метод заключался в следующем: воду распыляли на углеродную пленку, поверх которой была размещена сетка, и все быстро погружали в жидкий этан или пропан с температурой около –190оC (ее поддерживали за счет охлаждения жидким азотом). Оказалось, что тонкий слой стеклообразной твердой воды однородно поглощал электроны. От аморфного состояния воды к кристаллическому можно было перейти, нагревая образец до –140оC. В последующие годы Дюбоше усовершенствовал метод заморозки и приготовления образца для электронной микроскопии, а также описал результаты подробных исследований чистой воды, водных растворов и суспензий бактериофагов и молекул ДНК при криогенных температурах («Journal of Microscopy», 1982, 128, 219—237; doi: 10.1111/j.1365-2818.1982.tb04625.x).
Метод Дюбоше оценили в 1984 году, когда его группа опубликовала электронные микрографии суспензий вирусов («Nature», 1984, 308, 32—36; doi: 10.1038/308032a0). Методика позволяла получать достаточно тонкие слои воды для быстрого превращения в стеклообразное состояние, но при этом и достаточно толстые, чтобы в этом слое мог поместиться монослой биологически активных молекул или молекулярных комплексов в их естественной конформации (рис. 4).
Криоэлектронная микроскопия в наши дни
В последнее десятилетие существенно улучшились конструкционные элементы электронных микроскопов. Сейчас в них применяют новые детекторы, позволяющие регистрировать меньшее количество электронов, новые электронные пушки (источники электронов) и новые камеры, которые практически исключают колебания температуры, влияющие на точность исследования. Вся эта модернизация значительно повысила соотношение сигнал-шум и увеличила скорость анализа образца — в результате отдельные микрографии можно склеить в «фильм» из жизни молекул. Все это, как и предполагал Хендерсон в прошлом веке, превратило электронную микроскопию в распространенный и доступный метод исследования, применяющийся повсеместно, от материаловедения до исследования биологических систем.
Настоящий расцвет криоэлектронной микроскопии как метода для изучения биообъектов начинается с 2012—2013 годов и связан с появлением прямых электронных детекторов; с их помощью был, например, детально изучен ионный канал клеточной мембраны TRPV1 («Nature», 2013, 504, 107—112, doi: 10.1038/nature12822). И наконец, совсем недавно, в 2017 году, — всего через четыре года после опубликования первых статей, ставших основой для создания криоэлектронной микроскопии высокого разрешения, — этот метод позволил, как мы уже упоминали, исследовать молекулу гемоглобина в растворе («Nature Communications», 2017, 8, 16099; doi:10.1038/ncomms16099). Почти шесть десятилетий прошло с тех пор, как Джон Кендрю и Макс Перуц определили строение миоглобина и гемоглобина методом рентгеновской кристаллографии (именно благодаря этой работе в 1962 году они стали нобелевскими лауреатами).
За полвека пройден долгий путь. Для изучения биологической молекулы методом криоэлектронной микроскопии нет необходимости готовить ее кристаллический образец, а значит, для анализа требуется очень небольшое количество вещества. Метод позволяет анализировать частицы с массой в диапазоне от десятков килодальтон до нескольких мегадальтон. Разновидность метода — криоэлектронная томография может изучать и более крупные объекты, от комплекса биологически активных молекул до клеточного органоида и даже клетки. Криоэлектронная микроскопия изучает не только статичные структуры. Ионный фон, концентрацию низкомолекулярных веществ и рН охлаждаемого для анализа раствора можно систематически менять, что дает возможность определять структуру биообъектов в окружении, максимально близком к естественному. Метод криоэлектронной микроскопии даже делает видимыми изменения строения фермента, катализирующего реакцию («Nature», 2015, 521, 241—245; doi: 10.1038/nature14365). Практические приложения очевидны: детальное исследование биохимических процессов, изучение строения патогенных вирусов, создание новых и модификации существующих лекарственных препаратов.
В истории биохимических применений криоэлектронной микроскопии, вероятно, найдутся десятки имен, достойных упоминания. Однако лауреаты Нобелевской премии 2017 года — Жак Дюбоше, разработавший метод приготовления образцов для криоэлектронной микроскопии, Йоахим Франк, придумавший математические методы обработки сигналов от ансамблей частиц в растворах, и Ричард Хендерсон, впервые продемонстрировавший возможность применения криоэлектронной микроскопии для определения структур биомолекул с высоким разрешением, — действительно внесли огромный вклад в создание технологий для путешествий в глубины живой материи.
