Джон Дальтон и революция в химии

|
|
Джон Дальтон. 1834.
Гравюра Джеймса Лонсдейла |
Шестого сентября 2016 года исполняется 250 лет со дня рождения великого английского химика Джона Дальтона (1766–1844). Он занимался не только химией, но и другими научными дисциплинами, в частности математикой, метеорологией, языкознанием, был хорошим ботаником-любителем. Но именно его химические работы позволили совершить революционный скачок, после которого большинство исследователей пришло к выводу о реальности атомов и молекул.
Джон Дальтон родился в семье портного, родители его были квакерами. Систематического высшего образования Дальтон не получил и свои глубокие познания приобретал, общаясь с друзьями: слепым философом Джоном Гоухом (1757–1825), инженером и метеорологом Элиху Робинсоном (1734–1809) и другими.
В 1790 году Джон Дальтон устроился работать преподавателем математики в квакерском колледже в Манчестере. Однако десять лет спустя он покинул колледж, предпочитая зарабатывать на жизнь частными уроками, а в свободное время занимался научными исследованиями. Преподавателем Дальтон был неважным: не умел просто и ясно рассказывать, был малоэмоционален и даже зануден.
Первые научные работы Дальтона были посвящены метеорологии — независимо от физика Джорджа Хедли (1685–1768) он разработал теорию атмосферной циркуляции. Интерес к метеорологии Дальтон сохранял всю жизнь. Он вел «дневник погоды», в котором сделал около 200 тысяч записей о наблюдениях. А в 1801 году Дальтон опубликовал книгу, посвященную совершенно другому предмету: английской грамматике.
В начале 1800-х годов центром научных интересов Джона Дальтона становится химия. Его работы в этой области позволили сформулировать закон кратных отношений и дать экспериментальное обоснование стихийным представлениям об атомах.
До появления закона кратных отношений существование атомов было делом веры. Одни химики в атомы верили, как Михаил Васильевич Ломоносов (1711–1765), другие, например Антуан Лоран Лавуазье (1743–1794), — нет. Однако ни та, ни другая сторона не могла предложить серьезных аргументов в пользу своей точки зрения. Но в начале XIX века положение изменилось.
Это время ознаменовалось научной революцией в физике, химии и некоторых других дисциплинах. Главная ее идея — «Все связано со всем». Свет может вызывать химические изменения, идущий по проводнику электрический ток порождает тепло, магнитные явления связаны с электричеством. Безусловным лидером этой революции стал выдающийся немецкий исследователь Иоганн Риттер (1776–1810). В молодости он был активным членом и фактическим главой кружка гуманитариев, к которому принадлежали поэты Фридрих Новалис (1772–1801), Иоганн Фридрих Гёльдерлин (1770–1843), писатель Людвиг Тик (1773–1853), философ Фридрих Вильгельм Шеллинг (1775–1854). Кстати, знаменитое сравнение религии с опиумом принадлежит не классикам марксизма-ленинизма, а Новалису: «Ваша так называемая религия действует как опий: она завлекает и приглушает боли вместо того, чтобы придать силы». С кружком Риттера были связаны и молодой датский физик Ханс Кристиан Эрстед (1777–1851), который в дальнейшем покажет общность электрических и магнитных явлений, и биолог Лоренц Окен (1779–1851), в 1810 году высказавший гениальную мысль о том, что живые организмы построены из большого числа кирпичиков-клеток.
Исследуя связь между светом и химическими процессами, Риттер открыл ультрафиолетовые лучи: он выяснил, что хлорид серебра сильнее всего чернеет под действием излучения за пределами видимой области солнечного спектра. Он также создал первый аккумулятор, при зарядке которого электричество превращается в химические вещества, а при разрядке химические вещества превращаются в электричество. Думаю, что мы вправе считать Иоганна Риттера одним из основателей физики в современном ее понимании — научной дисциплины, способной с единых позиций рассматривать механическое движение, электрические, магнитные и оптические явления. Новые научные представления кружка Риттера были философски осмыслены в трудах его члена Фридриха Шеллинга.
В окружении Риттера много спорили о том, является ли вещество непрерывной субстанцией или же состоит из отдельных частичек — атомов. Сам Риттер к идее атомов относился скептически, хотя и поддерживал идею о дискретности электричества, которую впервые выдвинул Бенджамин Франклин (1706–1790).
Впрочем, дискуссии о дискретности вещества были бессмысленными — вопрос следовало решать экспериментально, чем и занялся Джон Дальтон.
В 1800 году он стал секретарем Манчестерского литературно-философского общества (несмотря на «гуманитарное» название, оно активно занималось естественными науками) и в 1801 году представил серию докладов о своих экспериментах, годом позже опубликованую в виде статей.
Логика рассуждений Дальтона сводится к следующему. В эксперименте обнаружено, что существует несколько разных соединений кислорода с азотом. При этом в одном из них 7 г азота связаны с 8 г кислорода, а в другом — с 16. А 16 в два раза больше, чем 8, поэтому логично предположить, что в первом случае одна частичка кислорода связана с одной частичкой азота, а во втором — с двумя. Таким образом, вещество состоит из отдельных частичек, которые можно назвать атомами.
Отсюда следует и другой вывод: массы частичек азота и кислорода неодинаковы. Масса частички азота составляет 7/8 от массы частички кислорода. Определить абсолютную массу отдельной частички определенного элемента было в те годы невозможно, но зато можно было сказать, во сколько раз масса атома одного элемента больше массы атомов другого.
Свою идею Джон Дальтон сформулировал в 1803 году в виде закона кратных отношений: «Если два элемента образуют друг с другом более одного химического соединения, то массы одного из этих элементов, приходящиеся на одну и ту же массу другого элемента, относятся друг к другу как небольшие целые числа». Однако гениальность Дальтона заключалась в том, что он увидел за этим законом дискретность строения вещества и существование атомов.
В 1808 году Джон Дальтон издает книгу «Новый курс химической философии» с изложением своих идей о строении вещества. Он ввел в химию понятие атомного веса, который измерялся, конечно, не в граммах, а в водородных единицах. Вес атома водорода принимается равным единице, атомный вес других элементов рассматривается как отношение их весов к весу атомов водорода.
Джон Дальтон установил (частично на основе собственных экспериментов, частично по данным, полученным другими исследователями) атомные веса некоторых элементов — водорода, кислорода, азота, углерода, серы, фосфора. В некоторых случаях неправильно: Дальтон, например, считал, что в состав молекулы воды входят один атом водорода и один атом кислорода, так что атомный вес кислорода у него получился равным 8, а не 16.
Основные идеи, внесенные в химию Джоном Дальтоном, можно сформулировать следующим образом:
1. Вещество состоит из очень маленьких частиц (атомов).
2. Атомы неделимы (их нельзя разложить на более мелкие частицы), они не появляются из ничего, не исчезают бесследно и не превращаются в атомы других элементов.
3. Атомы одного элемента одинаковы и отличаются от атомов других элементов.
4. Атомы разных элементов имеют различную массу.
5. Атомы разных элементов могут соединяться в химических реакциях, образуя химические соединения, причем каждое соединение всегда имеет одинаковое (простое, целочисленное) соотношение атомов в своем составе.
6. Относительные массы взаимодействующих элементов непосредственно связаны с массами самих атомов.
Последующее развитие науки внесло некоторые коррективы. Так, не все атомы одного элемента идентичны, существуют изотопы, сходные по химическим свойствам, но имеющие различные атомные веса; атомы, вообще говоря, делимы. Тем не менее эти положения составляют фундамент современной химии.
Другим научным направлением, сформировавшим представления об атомах и молекулах, стало исследование соотношений объемов газов, при которых они нацело реагируют друг с другом.
В 1802 году Жозеф Луи Гей-Люссак (1778–1850) показал, что при образовании воды один объем кислорода полностью реагирует с двумя объемами водорода. В 1808 году он же сформулировал закон объемных отношений, согласно которому объемы нацело реагирующих друг с другом газов относятся друг к другу как небольшие целые числа. А в 1811 году итальянский физик Амедео Авогадро (1776–1856) объяснил этот факт тем, что при одинаковых температурах и давлениях в равных объемах газа содержится одинаковое число частиц-молекул.
Гипотеза Авогадро позволила уточнить формулы многих химических соединений. Так, было обнаружено, что один объем водорода реагирует с одним объемом хлора, причем образуются два объема хлористого водорода. Отсюда следует, что в одной молекуле хлористого водорода содержится в два раза меньше атомов водорода, чем в одной молекуле водорода, и в два раза меньше атомов хлора, чем в одной молекуле хлора. Иными словами, и в молекуле водорода, ив молекуле хлора четное число атомов. Тем самым было опровергнуто мнение о том, что молекула водорода состоит из единственного атома. Самое простое предположение: в молекулах хлора и водорода по два одинаковых атома, а в молекуле хлористого водорода — один атом водорода и один атом хлора.
А теперь вернемся к воде. При ее образовании два объема водорода полностью реагируют с одним объемом кислорода, при этом получаются два объема водяного пара. Следовательно, атомов водорода в молекуле водяного пара столько же, сколько в молекуле водорода, то есть два. А число атомов кислорода в два раза меньше, чем в молекуле кислорода. Скорее всего, в одной молекуле воды только один атом кислорода, а в молекуле кислорода их два. Получается, что формула воды Н2О, а не НО, как полагал Дальтон, и атомный вес кислорода не 8, а 16. Сейчас даже люди, очень далекие от химии, знают, что вода — «аш-два-о». Тем полезнее вспомнить, как наука установила этот факт.
Закон кратных отношений Дальтона и закон объемных отношений, сформулированный Гей-Люссаком, стали первыми прорывами в экспериментальном обосновании существования атомов и молекул. Однако для того, чтобы ученый мир окончательно признал, что атомы и молекулы существуют, потребовалось еще полвека.
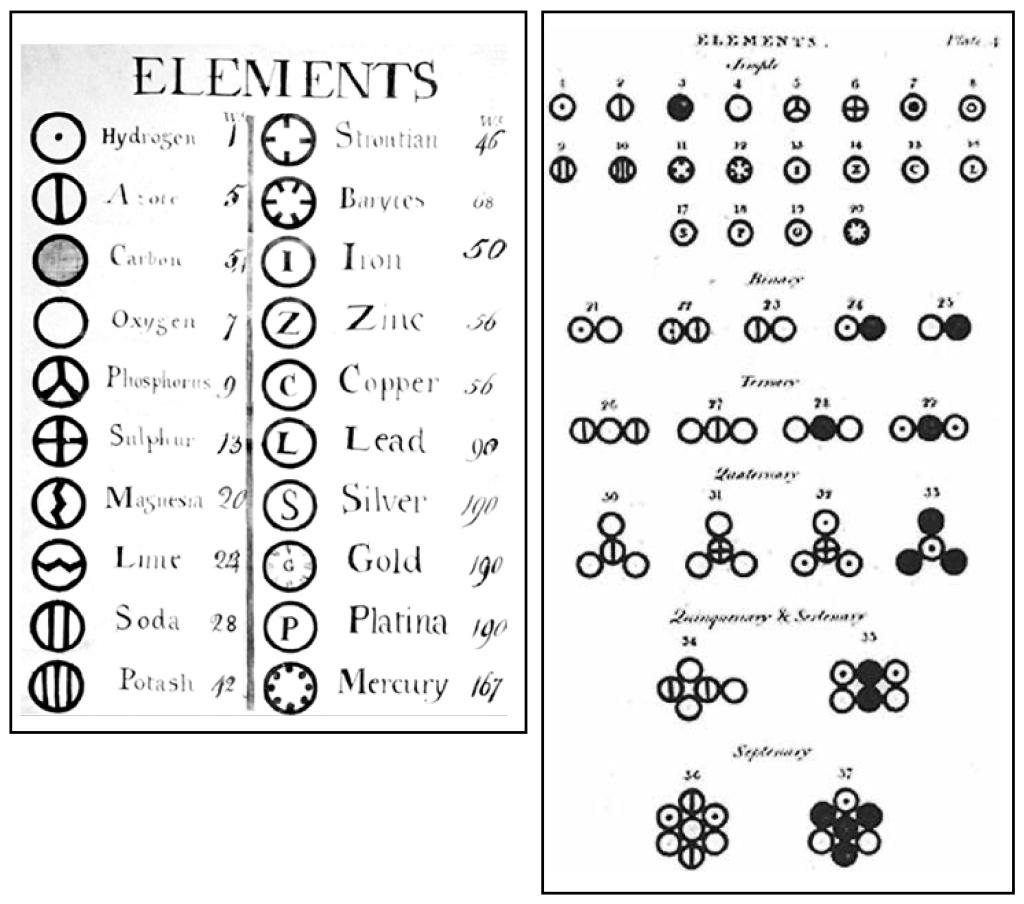
Джон Дальтон предложил систему обозначений химических элементов. Каждый элемент обозначался кружочком, в котором было что-то написано или нарисовано, они соединялись в молекулы. Похоже на современные модели молекул из шариков, но сходство поверхностное: эти «модели» не отражают ни диаметра атомов, ни длин связей и углов между ними, ни порядок соединения — только количества атомов. Эту не слишком удобную систему заменила та, которую предложил шведский химик Йенс Якоб Берцелиус в 1814 году и которой мы пользуемся по сей день.
 |
|
Система обозначения химических элементов по Дальтону. Молекулы из двух атомов он называл бинарными, трехатомные — терциарными и т. д.
|
Всем известный дефект зрения дальтонизм обязан своим названием Джону Дальтону. Еще в юности он обнаружил, что он воспринимает цвета окружающего мира не так, как все: «Та часть картины, которую другие называют красной, мне кажется как будто бы тенью или просто плохо освещенной. Оранжевый, зеленый и желтый кажутся оттенками одного цвета, от интенсивного до бледно-желтого». Те же особенности зрения были у его родного брата. Дальтон подробно описал свои наблюдения и пришел к выводу о том, что у него с братом имеется какое-то нарушение зрения, которое носит наследственный характер.
Как подобает настоящему исследователю, Дальтон завещал свои глаза для посмертного изучения. Глаз Дальтона многие годы хранился в лондонском Королевском институте, и в 1990-е годы из него была выделена и исследована ДНК. Теперь мы знаем, что у Дальтона была разновидность цветовой слепоты под названием дейтероанопия — в сетчатке его глаз не было колбочек, чувствительных к оттенкам зеленого. Дейтероанопией страдает каждый сотый мужчина, это более редкий случай в сравнении с дейтероаномалией, которая встречается у 6% мужчин — в их сетчатке «зеленые» колбочки есть, но пигмент, поглощающий в зеленой области спектра, поражен мутацией.
Казалось бы, дефекты цветового зрения препятствуют плодотворным занятиям ботаникой, однако на примере Дальтона мы видим, что это не всегда так. Я лично знаком с очень хорошим ботаником, страдающим дальтонизмом.
Стилем работы Дальтон больше походил на физика, чем на химика. Он пытался давать своим экспериментальным результатам простую физическую интерпретацию, чужие результаты всегда стремился перепроверить.
Большую часть жизни Дальтон нигде не служил и зарабатывал деньги репетиторством. Среди его учеников был сын предпринимателя-пивовара Джеймс Джоуль (1818—1889), который в дальнейшем стал знаменитым физиком.
С психологической точки зрения Джон Дальтон был ярко выраженным интровертом. Он не любил публичных выступлений, трудно сходился с людьми, никогда не был женат. В последние 26 лет жизни он занимал комнату в доме, где жила семья его друга — пастора и ботаника-любителя преподобного Джонса. Свой круг общения знаменитый ученый ограничивал немногочисленными близкими друзьями и заседаниями научных обществ.
Джон Дальтон умер в Манчестере 27 июля 1844 года после нескольких инсультов. Последняя запись в его метеорологическом дневнике датирована 26 июля.
