Новый природный антибиотик теиксобактин
 Год назад, в январе 2015го, американские исследователи из СевероВосточного университета в Бостоне объявили, что открыли новый природный и очень мощный антибиотик — теиксобактин («Nature», 2015, 517, 455—459, doi: 10.1038/nature14098, «Химия и жизнь», 2015, 2). Казалось бы, что здесь такого особенного? Антибиотиков полно, стоит заглянуть в аптеку. Однако это событие действительно необычное.
Год назад, в январе 2015го, американские исследователи из СевероВосточного университета в Бостоне объявили, что открыли новый природный и очень мощный антибиотик — теиксобактин («Nature», 2015, 517, 455—459, doi: 10.1038/nature14098, «Химия и жизнь», 2015, 2). Казалось бы, что здесь такого особенного? Антибиотиков полно, стоит заглянуть в аптеку. Однако это событие действительно необычное.
Во-первых, почти тридцать лет, начиная с 1987 года, химики не радовали общество новыми природными антибиотиками (только синтетическими!), хотя потребность в них огромна. Проблема в том, что бактерии приобретают устойчивость к антибиотикам и те перестают действовать на них. Поэтому создание новых препаратов, к которым бактерии не смогут быстро привыкнуть, — дело очень важное. И похоже, теиксобактин как раз из этой группы.
Однако главная особенность истории с новым антибиотиком кроется в том, как его получили. Микроорганизмы — самые распространенные живые существа на Земле. Их общая масса больше массы всех млекопитающих, включая человечество. Микроорганизмы живут повсюду — в воде, в воздухе, на земле и в земле, причем большинство — это бактерии и грибы.
С давних времен бактерии и микроскопические грибы сражаются со своими конкурентами, причем сражаются с помощью химического оружия – антибиотиков, которые сами и вырабатывают. Вот почему бактерии и грибы — потрясающий источник природных лекарств.
Однако есть проблема. Исследователям доступна лишь малая часть всех почвенных микроорганизмов, тех, что согласны размножаться в лабораторных условиях. За несколько десятков лет, пришедшихся на эру антибиотиков, исследователи выполнили практически исчерпывающий скрининг этой малой части. Остальные же 99% не растут в чашках Петри на питательной среде. Заслуга профессора Кима Льюиса и его команды заключается в том, что они открыли дверь в прежде закрытое и недоступное сообщество почвенных обитателей — создали технологию iChip, с помощью которой обнаружили теиксобактин.
Образец почвы хорошенько взбалтывают в большом количестве воды, чтобы микробные клетки разделились и болтались в суспензии поодиночке. Затем эту суспензию клеток добавляют в агарагар, а его, в свою очередь, заливают в iСhip – пластиковую матрицу с множеством углублений и канальцев, так, чтобы в каждом углублении оказалось по одной бактериальной клетке. Все это покрывают специальной мембраной, через которую питательные вещества беспрепятственно поступают к бактериям, а затем конструкцию закапывают в землю в стакане. Получается своего рода «подземный отель» для микробов, как прозвали его исследователи.
В этом случае несговорчивые бактерии начинают размножаться в контролируемых условиях и производить всяческие вещества, необходимые им для существования, в том числе и антимикробные. Остается только их выделить, идентифицировать и испытать. Понятно, что технология iChip сильно расширяет возможности микробиологов, потому что предоставляет доступ к гораздо большему разнообразию бактерий — потенциальных источников новых лекарств.
Используя этот метод, команда Льюиса вырастила бактерии, которые прежде не выращивали в лабораториях, и выделила 25 новых веществ с антимикробными свойствами, среди которых самымсамым оказался теиксобактин. Это вещество убивало бактерии стафилококка, устойчивые к известным антибиотикам, а также возбудителей туберкулеза, сибирской язвы и клостридий, вызывающих сильную диарею. Все они относятся к группе грамположительных бактерий.
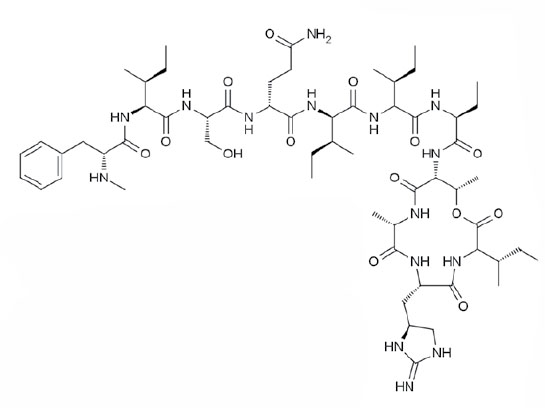
Бактерию, продуцирующую теиксобактин, назвали Eleftheria terrae (E.terrae). Элефтерия относятся к грамотрицательным бактериям, и против других грамотрицательных — например, кишечной палочки, сальмонеллы, хеликобактера — теиксобактин, к сожалению, не помогает. (Но, возможно, управа на них найдется у некультивируемых грамположительных бактерий?)
Исследователи из компании NovoBiotic Pharmaceuticals и Боннского университета выяснили, как новый антибиотик воздействует на бактерии. Теиксобактин оказался ингибитором клеточной стенки, то есть он мешает бактерия строить свою оболочку, в результате она не может размножаться.
Сейчас теиксобактин испытывают на животных. Он отлично показал себя на мышах, зараженных резистентным стафилококком, и если все пойдет по плану, то в 2017 году начнутся клинические испытания. Исследователи надеются, что грамположительные бактерии долго не сумеют приспособиться к новому антибиотику, — скажем, устойчивость к ванкомицину появилась лишь спустя 30 лет. Посмотрим.
