Моментальный снимок белкового синтеза
«Найден ген аутизма», «ученые обнаружили ген, из-за которого женщины разговорчивее мужчин», «доказано существование гена бессмертия»... У менее сенсационных генетических открытий мало шансов попасть в новости: то, что ученые выявили функцию еще одного из многих тысяч генов, кажется почти рутиной. А спросите читателя новостей, каким образом ученые узнают, что делает тот или иной ген или почему мутация в этом гене, а не в другом становится причиной болезни, — и услышите самые фантастические версии, например: «Взяли у больного клетку и посмотрели в микроскоп, где у него мутация». Или честное признание: «Никогда об этом не думал».
Методы в науке не менее важны, чем результаты, ведь результаты, по сути, определяются методами. Современные технологии «чтения» ДНК — секвенирования, полимеразная цепная реакция (ПЦР), биоинформатика сделали возможными такие исследования, каких четверть века назад не могли вообразить даже фантасты — в повестях Стругацких люди XXII века воспринимают геном как нечто еще более таинственное, чем глубокий космос.
Метод, о котором мы собираемся рассказать в этой статье, вероятно, не настолько значителен, как ПЦР или суперсовременные методы секвенирования. Он «всего-навсего» показывает, какие матричные РНК присутствуют в клетке и, главное, на каких из них и насколько интенсивно синтезируются белки. «Этот метод позволяет получить моментальный снимок белкового синтеза в клетке», — говорит доктор химических наук И.Н.Шатский, главный научный сотрудник НИИ физико-химической биологии им. А.Н.Белозерского (МГУ), руководитель лаборатории регуляции синтеза белка. По материалам лекции, которую Иван Николаевич прочитал на школе «Современная биология & биотехнологии будущего» (см.с.15), написана эта статья.
Немного о трансляции
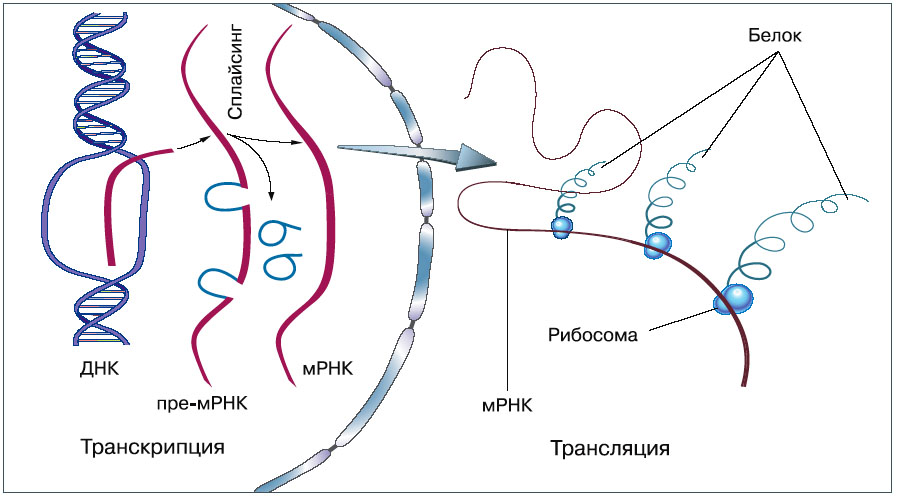
Напомним вкратце важнейшие положения. Белки — основной строительный материал жизни, а информация о белках, как часто говорят, «записана в генах». Гены состоят из кодирующих участков, в которых содержится информация о последовательности аминокислот в белках, и регуляторных, управляющих активностью гена. Эта активность проявляется прежде всего в транскрипции, синтезе матричной РНК (мРНК), а затем — в синтезе белка на мРНК, или трансляции. (На самом деле есть и такие гены, которые не кодируют белки, а кодируют только РНК, но не будем на них отвлекаться.) Белок синтезируют рибосомы — прекрасные и сложные молекулярные машины (см. «Химию и жизнь», 2009, № 12).
Геном клетки часто сравнивают с огромной библиотекой, мРНК — с копиями чертежей и технических заданий, которые геном выдает по запросу клетки, чтобы та могла создавать для себя все необходимые устройства. Если воспользоваться более современной аналогией, геном — это массив информации на некоем сайте в Интернете, а мРНК — «клики», запросы той или иной информации. Однако самые кликабельные страницы — не всегда самые полезные. Представим, например, сайт, посвященный моделированию: какой-нибудь «шагающий гексакоптер» будут часто скачивать — любопытно же, чем он шагает, — но вряд ли многие захотят построить это диво. А вот файл «радиоуправляемый вертолет для начинающих» не только получит много кликов, но и породит множество реальных вертолетиков. Таким образом, скопировать информацию из генома — полдела: активность гена определяется тем, что по этой копии будет построено. Возвращаясь к нашей терминологии — не только транскрипцией, но и трансляцией.
Да, бывает и так, что мРНК в клетке есть, а синтез белка на этой матрице не идет. Например, он может быть временно запрещен, а когда запрет перестанет действовать, клетка получит этот белок быстро, не тратя времени на транскрипцию. Вот такая сложная, многоуровневая регуляция.
Про геном человека шутят, что «мы получили книгу, но не умеем ее читать». Активность генов, различная в разных клетках, тканях, организмах, или в одном и том же, но в разных условиях — это и есть правила, по которым читается книга, и здесь в настоящее время находится передний край биологической науки.
Существуют методы, позволяющие выделить все полностью синтезированные мРНК или исследовать, как сейчас говорят, протеом — совокупность всех белков, синтезированных клетками определенного типа, например, с помощью масс-спектрометрии. Но метода, который позволил бы «сфотографировать» транскрипцию и трансляцию — показать набор мРНК, их «востребованность» в некий интересный для ученых момент жизни клетки, например в течение получаса после воздействия на культуру потенциального лекарства или заражения вирусом, — у нас не было до 2009 года. До того как Николас Инголиа, постдок лаборатории Джонатана Вайсмана (Калифорнийский университет, Сан-Франциско), предложил вниманию научного сообщества рибосомный профайлинг. (В 2010 году Инголиа переехал в Балтимор, сейчас он руководитель группы в Институте Карнеги, www.ingolia-lab.org/)
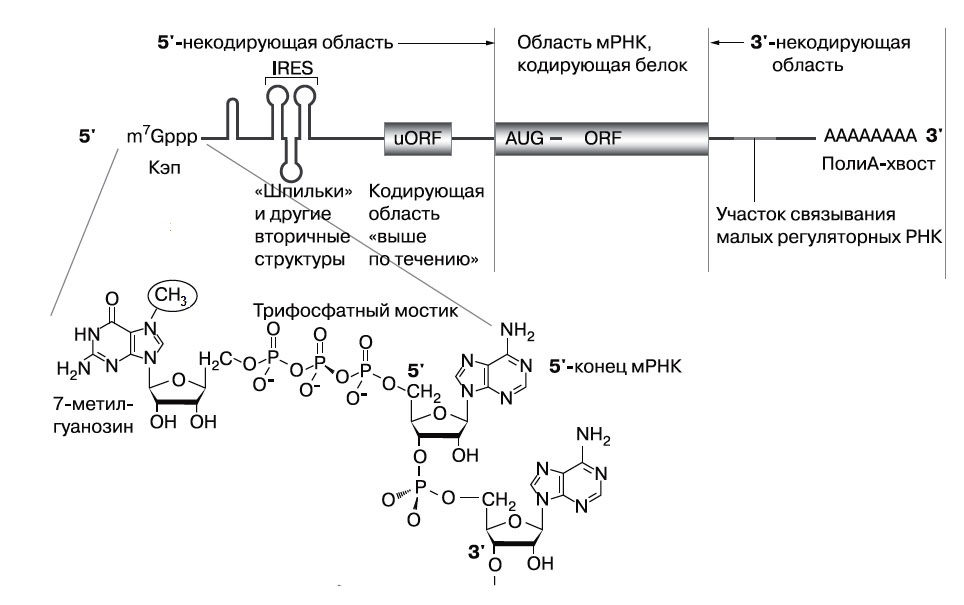
Прежде чем перейти к собственно методу, расскажем подробнее о трансляции, а заодно и о структуре мРНК, которую схемы «для широкой публики» изображают в виде простой линии.
В эукариотической клетке (имеющей ядро, в отличие от клетки бактериальной) у всех мРНК есть кэп — «шапочка»: 7-метилгуанозин, прикрепленный трифосфатным мостиком к «головному» 5'-концу. Кэп играет ключевую роль во многих важных событиях жизни мРНК. Далее, мРНК — вовсе не «просто ниточка»: ее 5'-конец скручивается сам вокруг себя, формируя двойные спирали, похожие на спираль ДНК. Примерно так ведет себя мягкий провод, вроде шнура от наушников. Но скручивание РНК происходит не случайным образом, а определяется последовательностью нуклеотидов в этом участке, и все эти петли, «шпильки» и прочие вторичные структуры, вероятно, для чего-то нужны.
У вирусных РНК в 5'-некодирующем участке имеется IRES — (Internal Ribosome Entry Site — участок внутренней посадки рибосомы). Это 300—400 нуклеотидов, которые уложены весьма затейливо, с множеством двуспиральных участков. У эукариот обычно связывание рибосомы с матрицей зависит от кэпа. А как же в таком случае рибосомы клетки, зараженной вирусом, транслируют вирусные РНК, у которых кэпа нет? Благодаря IRES — субчастица рибосомы может связываться не только с кэпом, но и с ним. Бывают ли IRES у эукариотических мРНК — на этот вопрос многие специалисты, а также интернет-энциклопедии уверенно отвечают «да», однако на самом деле он остается спорным.
Помимо основной кодирующей области (ее обычно называют open reading frame — ORF), в 5'-области мРНК эукариот может быть еще и uORF — загадочная «рамка считывания выше по течению», возможно, и не одна. Зачем они нужны, не до конца ясно. Что касается 3'-некодирующего участка, наиболее примечательная его особенность — полиА-хвост, примерно полтораста остатков А. Он защищает мРНК от ферментов экзонуклеаз, а также — сюрприз! — регулирует инициацию, то есть начало трансляции. Дело в том, что мРНК только на картинках линейна, а в клетке она, будучи достаточно гибкой и длинной, охотно сворачивается в кольцо, так что «хвост» может участвовать в делах «головы». Не случайно там же, в 3'-некодирующей области, находятся участки связывания малых регуляторных РНК, о которых сейчас так много говорят. А длина этой области может составлять тысячи нуклеотидов, зачастую она гораздо длиннее самой рамки считывания, как комментарии к сонету Шекспира длиннее самого сонета.
Конечно, это тоже было краткое изложение для широкой публики: мы не сказали ни о белках, которые связываются с мРНК, ни о других белках-кофакторах, которые не входят в состав рибосомы, однако «ассистируют» ей при сканировании 5'-конца и на разных этапах трансляции. Но теперь уже можно переходить к рибосомному профайлингу.
Отпечатки рибосом
Как узнать, какие мРНК транслируются в клетке в данный момент? Выделить их и попытаться выяснить, где на них сидят рибосомы. Известно, что активно транслируемые РНК имеют вид полирибосом, или полисом, — на одной мРНК может быть много рибосом, как бусин на нити, и каждая строит молекулу белка. Если же инициация по какой-то причине затруднена, то рибосом на молекуле мРНК мало или совсем нет.
|
|
Структура матричной РНК. Как все тексты, молекулы нуклеиновых кислот нельзя читать задом наперед, у них есть начало и окончание, 5'- и 3'-концы. Они названы по номерам атомов углерода в кольце рибозы или, в ДНК, дезоксирибозы (в отличие от атомов азотистого основания, они пронумерованы со штрихами). Рибосома движется от 5'- к 3'-концу. Это направление называется «вниз по течению» — downstream, а противоположное — upstream, «вверх по течению». Малая субчастица рибосомы распознаёт кэп эукариотической мРНК или садится на IRES у вирусной мРНК и движется «вниз по течению», пока не найдет кодон AUG — там присоединяется большая субчастица, и рибосома начинает синтез белка. |
Инголиа использовал тот факт, что во время трансляции внутри каждой рибосомы находится участок мРНК длиной 28—30 нуклеотидов. Положение такого «текстового фрагмента» вполне возможно установить. А значит, если мы прочитаем буквенные последовательности всех фрагментов мРНК, на которых в данный момент сидят рибосомы, мы узнаем все или почти все, что нам нужно знать.
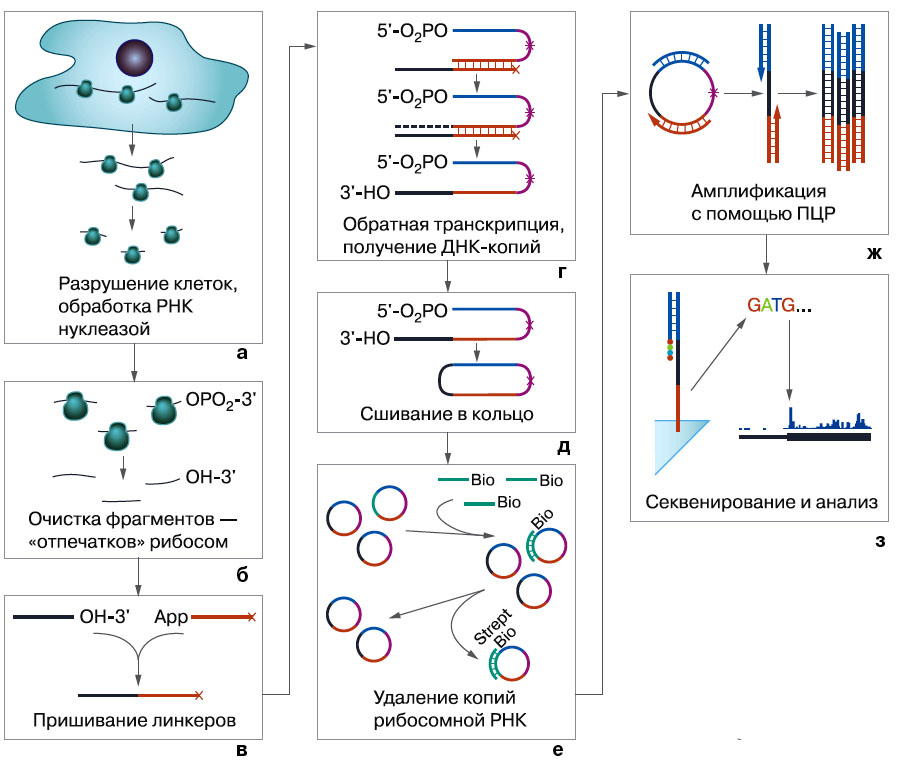
Для начала рибосомы надо остановить: они движутся по мРНК (или тащат ее через себя, в зависимости от точки зрения) со скоростью десятки триплетов в секунду. Роль фотовспышки, «замораживающей» движение, играет антибиотик циклогексимид — он останавливает трансляцию, рибосомы замирают на мРНК. Затем клетки разрушают и обрабатывают полирибосомы ферментом рибонуклеазой из кишечной палочки, который нещадно рвет все нити РНК, кроме участков, защищенных рибосомами (а). Как если бы нитку с прилипшими к ней бусинами бросили в огонь или кислоту и сохранились лишь кусочки нитки внутри бусин.
Итак, у нас в руках множество фрагментов РНК, очищенных от рибосом, длиной примерно по 30 нуклеотидов — обрывки всех мРНК, какие есть в клетке (б). Или почти всех, есть ведь и плохо транслируемая мРНК. Чтобы узнать их последовательность, с них надо снять ДНК-копии (методы секвенирования РНК существуют, но используются редко) — получить библиотеку комплементарных ДНК, или кДНК.
|
| Транскрипция — копирование генетической информации с ДНК на мРНК. Кодирующая последовательность гена у высших организмов не непрерывна — чтобы получилась пригодная к работе мРНК, «лишние» участки вырезаются (этот процесс называется сплайсингом). Трансляция — синтез белка на матрице мРНК — следующий этап, и происходит он не в ядре, а в цитоплазме |
Для этого ко всем таким фрагментам пришивают одинаковые «хвосты» — линкеры (в), с ними комплементарно соединяется ДНК-фрагмент, и производится обратная транскрипция — синтез ДНК на матрице РНК (г). Получается набор молекул ДНК: одна часть у них стандартная, а другая — комплементарная РНК-фрагментам, у каждого своя. Эти фрагменты замыкаются в колечки (д). Звездочкой на рисунке показана специальная гибкая связь ненуклеотидной природы, которая снимает напряжение и облегчает циклизацию.
Тут есть еще один подводный камень. В состав рибосом, как известно, тоже входят РНК, точнее, три молекулы рибосомной РНК (рРНК) — это каркас субчастиц рибосомы, покрытый белками. Конечно, нуклеазы немного «погрызают» и рибосомы, поэтому кусочки рибосомной РНК присутствуют в образце, и от их ДНК-копий необходимо избавиться. Для этого берут однонитевые молекулы ДНК, комплементарные рРНК (точнее, их ДНК-копиям), с пришитым биотином. Биотин, он же витамин Н или В7, биохимики любят за высокое сродство к стрептавидину, белку, вырабатываемому бактерией Streptomyces avidinii. Если, например, прикрепить стрептавидин к агарозному гелю и через него пропустить наш раствор, в нем останутся молекулы биотина и пришитые к ним молекулы ДНК, а те зацепят на себя молекулы рибосомного «мусора» (е).
|
|
Рибосомный профайлинг: основные этапы |
После этого уже можно получать двунитевые линейные копии интересующих нас фрагментов с помощью полимеразной цепной реакции. (Об этом замечательном методе «Химия и жизнь» писала не раз.) Праймеры-затравки подбирают к известным участкам колечек таким образом, чтобы интересующие нас фрагменты оказывались между ними (ж). Получившиеся линейные молекулы секвенируют в специальном приборе (е). Например, на факультете биоинженерии и биоинформатики МГУ есть секвенатор Illumina HiSeq2000, способный «прочитать» за один раз до полутора миллиардов фрагментов ДНК! Правда, относительно коротких фрагментов, но в данном случае длинных и нет.
Рибосомный профайлинг прекрасен тем, что он дает широкую картину генной активности в короткий промежуток времени, действительно «моментальный снимок», который можно долго изучать. Ограничения метода — сравнительно высокая стоимость как самого аппарата глубокого секвенирования, так и каждого его прогона (порядка 10 тысяч долларов!). Видимо, поэтому он используется не очень широко. Однако «чтение» ДНК дешевеет год от года, так что все еще впереди.
Метод кажется простым, но на самом деле он включает в себя 60 с лишним операций — мы перечислили только основные этапы, а многие тонкости опустили. Например, Инголиа немало потрудился, подбирая условия, при которых все мРНК были бы представлены в библиотеке одинаково, независимо от того, много или мало в них вторичных структур.
Пока еще мы ничего не сказали о контроле, ведь надо выяснить и то, сколько в клетках различных мРНК, как хорошо, так и плохо транслируемых.
Для этого изучаемые клетки делят на две части: в одних ищут 30-нуклеотидные «отпечатки» рибосом, как мы только что рассказали, из других выделяют всю РНК, содержащую полиА-хвост, — суммарную мРНК, затем нуклеазой или щелочью расщепляют ее на небольшие фрагменты и аналогичным образом создают библиотеку. Эта библиотека покажет, сколько было в клетке мРНК каждого типа.
Дальше кончается «мокрая» биология и начинается биоинформатика. Надо найти, каким мРНК принадлежат фрагменты, которые были заняты рибосомами. Длина фрагментов позволяет это сделать — мы же угадываем, откуда взята строчка «Так думал молодой повеса», а откуда «Мело весь месяц в феврале». (Хотя, конечно, в отдельных случаях возможны сомнения: как поэты иногда повторяются либо цитируют друг друга, так и в генах есть повторяющиеся участки.) По контролю мы судим о количестве мРНК, по количеству защищенных фрагментов — об интенсивности их трансляции, о том, сколько рибосом занято синтезом того или иного белка. Если построить график зависимости количества «посадочных мест» рибосом от положения того или иного участка в геноме, пики придутся на активные гены, плато — на нетранслируемые области.
Результаты
Что же можно узнать с помощью рибосомного профайлинга? Можно выяснить, как изменилась интенсивность трансляции после воздействия лекарственного препарата, или яда, или вирусной инфекции. (Особенно интересно, если некий белок неожиданно начал синтезироваться в ответ на воздействие.) Можно сопоставить эти эффекты со структурой 5'- и 3'-не- кодирующих областей и сделать пред- положения о механизмах регуляции. Можно проверить, не замедляют ли движение рибосом те или иные последовательности в мРНК: если замедляют, то интервалы между рибосомами должны изменяться. И в самом деле, выяснилось, что есть такие участки, где они притормаживают, как поезда перед населенным пунктом! Можно «поймать» рибосомы на той самой uORF, рамке считывания «выше по течению» — кстати, именно Инголиа в своих работах доказал, что uORF встречаются чаще, чем полагали до сих пор, и рибосомы действительно зачем-то их читают.
Пример теоретически важных и практически значимых результатов, полученных с помощью рибосомного профайлинга, — две статьи в одном номере «Nature», посвященные киназе mTOR, которая играет важную роль в регуляции роста, деления и выживания клеток, в частности, и при развитии рака (Hsieh et al., «Nature», 2012, 485, 55-61, Thoreen et al, 109—113; среди соавторов первой — Инголиа и Вайсман, его бывший шеф). Киназами называются ферменты, присоединяющие фосфатные группы (фосфорилирование белков — способ регуляции самых разных внутриклеточных процессов). Буква m означает mammalian, то есть белок млекопитающих, TOR — target of rapamycin, то есть мишень рапамицина. А рапамицин, в свою очередь, назван по острову Пасхи — Рапа-Нуи, где были найдены микроорганизмы, вырабатывающие это вещество. Необычен в рапамицине его широкий спектр применения: это и антибиотик, и иммунодепрессант (средство, угнетающее иммунную систему при пересадке органов и тканей), и противораковое средство. Рапамицин подавляет действие mTOR. (О влиянии mTOR и рапамицина на старение «Химия и жизнь» писала в № 1, 2009.) Но что делает сама киназа и почему ее надо подавлять, чтобы остановить развитие опухоли или, скажем, размножение клеток иммунной системы?
Известно было, что mTOR регулирует трансляцию очень многих мРНК, кое-что известно и о том, как именно она это делает, но оставалось не до конца ясным, какими признаками должна обладать мРНК, чтобы попасть под управление mTOR. Исследователи создали ингибиторы для этой киназы, действующие более прямо, чем рапамицин,—на сам активный центр, и обработали ими культуру клеток, а затем с помощью рибосомного профайлинга посмотрели, что изменилось, — то есть трансляция каких мРНК, возможно, «подчиняется» mTOR. Оказалось, что для них характерно наличие в 5'-некодируемой области так называемого олигопиримидинового мотива, то есть участка, где мало пиримидиновых нуклеотидов, C и U (работа Торина и соавторов). А вот некоторые другие предположения — например, что это должны быть матрицы с особенно длинным или структурно сложным 5'-регионом, — не подтвердились.
Интересно, что после воздействия ингибитором mTOR резче всего снижается трансляция белков, входящих в структуру самих рибосом, а также других, связанных с ростом и белковым синтезом. Можно предположить, что mTOR «разрешает» раковой клетке обеспечиваться строительным материалом в соответствии с ее непомерными аппетитами, а противораковые средства, действующие на эту киназу, разрешение отменяют. И еще один примечательный момент: ингибитор mTOR, предложенный авторами первой из двух статей, способен стать прототипом лекарства против метастазов даже в таком тяжелом случае, как рак простаты, — выявленные ими гены отвечают в том числе за метастазирование. Это вещество, получившее название INK128, уже проходит клинические испытания.
Вот таким коротким (если сравнивать с нашими реалиями) может оказаться путь от нового метода исследований, вроде бы никому, кроме молекулярных биологов, не интересного, до нового потенциального лекарства.
Литература
Ingolia N.T., Ghaemmaghami S., Newman J.R., Weissman J.S.. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. «Science», 2009, 324 (5924), 218—223.
Ingolia N.T., Lareau L.F., Weissman J.S. Ribosome profiling of mouse embryonic stem cells reveals the complexity and dynamics of mammalian proteomes. «Cell», 2011, 147, 1—14.
