Одна молекула и семь нобелевских лауреатов
У римлян ни за что не хватило бы времени на завоевание мира, если бы им пришлось сперва изучать латынь.
Генрих Гейне
 |
|
Коллаж М.Левицкого |
В истории химии случались события, по своему драматизму напоминавшие штурм неприступной вершины, на которую одновременно по различным маршрутам пытаются взойти независимые группы альпинистов. Речь пойдет о получении инсулина. Синтез этого соединения был хорошо подготовлен (это напоминает базовые, промежуточные лагеря альпинистов), но не теми, кто вышел на покорение вершины, а основательными работами исследователей-предшественников. Развитие химии инсулина получило в наши дни продолжение, которое совершенно не могли предугадать те, кто его создавал.
С этой популярнейшей молекулой ХХ столетия связаны имена семи нобелевских лауреатов.
Белок, спасающий жизнь
В середине ХХ столетия инсулин изучали очень интенсивно. Оказалось, что именно этого гормона не хватает при сахарном диабете. Инсулин запускает процессы, обеспечивающие проникновение глюкозы в клетки, а также стимулирует внутриклеточные механизмы, ответственные за усвоение глюкозы. Когда инсулина не хватает, глюкоза не расходуется клетками, а значит, накапливается в крови и через почки выводится мочой. Больной худеет, у него выделяется слишком много мочи, он постоянно хочет пить и есть. Организм старается компенсировать дефицит калорий, которые он теряет в виде глюкозы с мочой, и начинает использовать жировые запасы и тканевые белки (главным образом мышечные). Возникают утомление, сонливость, тошнота. Если диабет не лечить, то больной погибает.
Сахарным диабетом болеют во всех странах, представители всех рас. Самое раннее его описание сделали примерно 3000 лет назад в Древней Индии, но более подробно симптомы болезни описали в I веке н.э., назвав ее от греческого diabatas — истечение. Это заболевание планомерно изучали не одно столетие. В XVII веке английский врач Томас Уиллис обнаружил, что моча у пациентов с такими симптомами сладковатая (он был настоящий ученый). Картина начала проясняться после опытов французского физиолога Клода Бернара (1813–1878) и немецких физиологов Йозефа фон Меринга и Оскара Минковского (1889), которые наблюдали собак с удаленной поджелудочной железой. Тогда стала очевидной связь между поджелудочной железой и сахарным диабетом.
Физиологи предположили, что поджелудочная железа вырабатывает вещество, которое ответственно за усвоение в организме глюкозы, а в 1916 году немецкий физиолог Шарпи-Шафер назвал это гипотетическое вещество «инсулином» (от латинского инсула – «островок», поскольку в поджелудочной железе группы клеток назвали островками Лангерганса). В 1921 году трое канадских исследователей Джон Маклеод, Фредерик Бантинг и Чарльз Бест смогли выделить инсулин из поджелудочной железы подопытных животных. Первые же опыты показали, что если ввести полученный препарат собакам с удаленной поджелудочной железой, то у них снижается уровень сахара в крови и заметно улучшается состояние. Первым пациентом, получившим инсулин 11 января 1922 года (знаменательная дата в истории мировой медицины), был четырнадцатилетний канадец Леонард Томпсон, страдавший тяжелой формой диабета.
В 1923 году Маклеод и Бантинг получили за открытие инсулина Нобелевскую премию по физиологии и медицине. Беста не оказалось в списке лауреатов, и Бантинг отдал ему половину полученных денег. С 1926 года было налажено серийное производство инсулина, и тысячи больных сахарным диабетом, ранее обреченных на смерть, смогли вести сравнительно нормальную жизнь.
От медицины к химии
Физиологи Маклеод, Бантинг и Бест использовали для лечения больных экстракт поджелудочной железы животных, но у химиков несколько иной подход — их всегда интересовало, как именно устроено то или иное соединение. Впервые инсулин в кристаллическом виде сумел выделить в 1926 году Джон Абель, именно благодаря его работам удалось наладить промышленное производство лекарства. Абель также определил состав (но не строение) инсулина, после чего стало понятно, что это молекула белка. Начиная с этого момента исследование инсулина переходит из рук медиков к биохимикам.
Необходимо было выяснить, как устроена молекула, привлекавшая внимание столь большого числа исследователей. Эту задачу решил американский биохимик Фредерик Сенгер, который в 1958 году получил Нобелевскую премию «за работы по структуре протеинов, особенно инсулина». Вначале он разработал способ, с помощью которого можно было определить природу концевой группы в белковой молекуле (этот метод стал классическим — обработка в щелочной среде динитрофторбензолом). Потом он буквально разобрал на части всю молекулу инсулина и определил состав полученных аминокислот с помощью самых современных методов — электрофореза, разработанного Арне Тиселиусом (Нобелевская премия 1948 года), и хроматографии, усовершенствованной Арчером Мартином и Ричардом Сингом (нобелевские лауреаты 1952 года). Однако установить, из каких аминокислот собран белок, — лишь половина дела, притом менее сложная. Главное выяснить их последовательность в цепи.
Сенгер разработал план, по которому с помощью специально подобранных ферментов расщеплял цепь в разных заранее намеченных участках на небольшие отрезки, а потом сопоставлял их состав. Работа представляла собой безупречное сочетание логики и экспериментального мастерства. Свой метод Сенгер довел буквально до совершенства, и со временем он стал классическим при исследовании структуры белков.
Отметим, что Сенгер на этом не остановился. Применив похожие логические построения, а также несколько изменив методику и реагенты, он сумел установить последовательность нуклеотидов в ДНК. За эти исследования в 1980 году Сенгеру (совместно с Уолтером Гилбертом и Полом Бергом) была присуждена Нобелевская премия. На сегодня — Сенгер единственный дважды нобелевский лауреат по химии. Никто в то время не мог предположить, что эти исследования ДНК позволят со временем открыть новую страницу в химии инсулина, но об этом речь несколько позже.
Американский биохимик Винсент дю Виньо, в течение нескольких лет изучавший инсулин, узнав о работах Сенгера по расшифровке структуры, решил воспользоваться его методикой, однако пошел дальше. Он не только установил строение двух гормонов (вазопрессина и окситоцина), но и сумел их синтезировать. Фактически он первый сумел синтезировать природные полипептиды. Эту его работу также отметили Нобелевской премией 1955 года, то есть он получил премию на три года раньше Сенгера, чьи идеи помогли ему добиться столь великолепного результата. Работы дю Виньо фактически открыли дорогу к синтезу инсулина, но его молекула была сложнее, чем два уже полученных гормона, кроме того, еще не были разработаны способы, позволяющие связать две полипептидных цепи дисульфидными мостиками.
Тем временем оказалось, что цинковый комплекс из нескольких молекул инсулина (так называемый Zn-инсулин) обладает более длительным лечебным действием. Строение этого комплекса оказалось весьма сложным (он содержит почти 800 атомов), поэтому были привлечены физикохимические методы анализа. В 1972 году английский биофизик Дороти Кроуфут-Ходжкин (лауреат Нобелевкой премии 1964 года за определение с помощью рентгеновских лучей структур биологически активных веществ) установила структуру этого необычайно сложного комплекса.
Компактный язык биохимиков
Прежде чем мы рассмотрим строение молекулы инсулина, вспомним, как биохимики изображают молекулы белков. Все белки — это полимеры, цепи которых собраны из остатков аминокислот. В состав аминокислот входят аминогруппа NH2 и карбоксильная группа СООН. В образовании белков участвуют только такие аминокислоты, у которых между амино- и карбоксильной группой — всего один углеродный атом (общий вид формулы: H2N–CH(R)–COOH). Группа R, присоединенная к атому углерода между амино- и карбоксильной группой, определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит различные функциональные группы. Из всего многообразия аминокислот (теоретически их количество неограниченно) в образовании белков участвуют только двадцать, так называемых фундаментальных. Для строительства инсулина природа использовала 16 аминокислот.
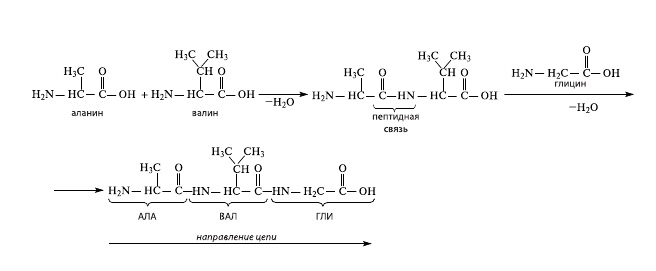
Аминокислоты в белковой молекуле соединяются последовательно, при этом карбоксильная группа одной кислоты взаимодействует с аминогруппой соседней молекулы, в результате образуется пептидная связь –CO–NH– и выделяется молекула воды (рис. 1). Получается, что при любом количестве соединяемых аминокислот на одном конце цепочки обязательно будет находиться аминогруппа, а на другом — карбоксильная. Вместо структурной формулы часто используют сокращенное обозначение, например АЛА-ВАЛ-ГЛИ, что означает последовательность аминокислот «аланин-валин-глицин». Поскольку аминокислот, используемых природой, всего двадцать, то так можно компактно записать формулу любого белка, и никакой неясности при этом не возникает.
 |
|
1.Так образуется цепь аминокислот
|
 |
|
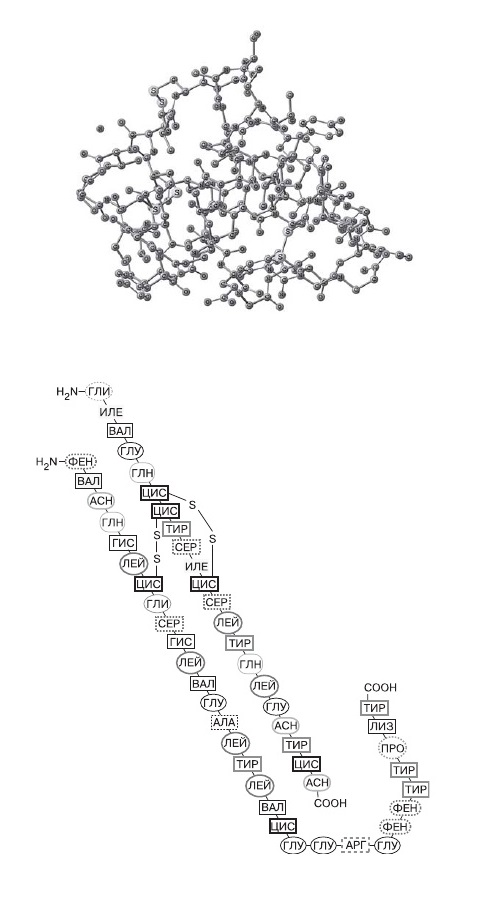
2.Пространственная модель молекулы инсулина и ее условное изображение |
Молекула инсулина, как установил Ф.Сенгер, состоит из 51 аминокислотного остатка и представляет собой две соединенные между собой параллельные цепи неодинаковой длины (рис. 2). Обратите внимание, что входящие в цепь остатки аминокислоты цистеина (ЦИС) образуют дисульфидные мостики –S–S–, которые связывают две полимерных молекулы и, кроме того, образуют перемычку внутри одной цепи. Если сравнить изображение, принятое в биохимии, и формулу в виде объемной шаростержневой модели, то очевидно, что первое компактно и очень удобно.
От демонтажа к сборке
Казалось бы, после того, как установлена структура молекулы, синтезировать ее заново не составит большого труда. Ведь если изделие собрано на резьбе, то разобрать и собрать его несложно, нужна лишь отвертка или гаечный ключ. Но если это отливка или сварное изделие, то разобрать или распилить, а затем собрать вновь совсем непросто. В этом случае разборка и сборка — совершенно разные по способам решения задачи.
Основная трудность при сборке белковой молекулы — добиться, чтобы необходимые аминокислоты соединились строго в намеченном порядке. При этом следует помнить, что каждая аминокислота может реагировать не только с другой аминокислотой, но и сама с собой, поэтому в итоге может получиться молекула, не имеющая ничего общего с тем, что синтезирует живой организм.
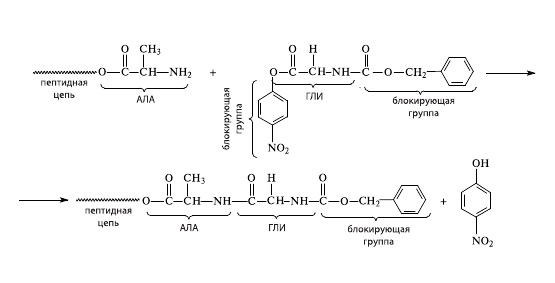
К моменту, когда решался вопрос о синтезе инсулина, было разработано несколько соответствующих методик. Чтобы аминокислота, которую намечено было присоединить к растущей цепи, не реагировала сама с собой, ее реакционноспособные концы (аминогруппу NH2 и карбоксильную группу СООН) блокировали специальным образом: карбоксильную группу переводили в п-нитрофениловый эфир, а со стороны аминогруппы присоединяли карбоксибензильную группу. Такая блокированная молекула реагировала с аминогруппой, находящейся на конце растущей цепи (рис. 3). В результате цепь удлинялась на одно пептидное звено.
 |
|
3.Сборка белковой молекулы: присоединение первой аминокислоты |
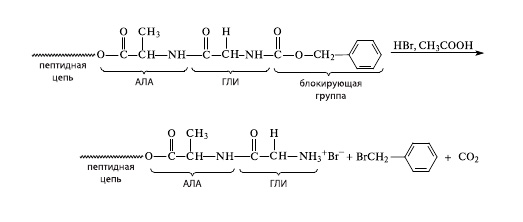
Однако теперь на конце цепи разместилась блокирующая карбоксибензильная группа. Из показанной выше схемы следует, что цепь наращивают со стороны «аминного» конца этой цепи — того, который оказался заблокированным. Следовательно, нужно сделать этот «аминный хвост» реакционноспособным, то есть перевести его в активную форму. Это делали с помощью бромоводорода с уксусной кислотой (рис. 4). В результате аминогруппа на конце цепи вновь готова реагировать с очередной аминокислотой (естественно, тоже содержащей блокирующие группы). Параллельно были разработаны также несколько иные методы сборки полиамидных цепей.
 |
|
4.Сборка белковой молекулы: присоединение второй аминокислоты |
Штурм вершины
 |
|
Молекулу инсулина синтезировали одновременно несколько групп. Питсбургская группа (вверху), Аахенская группа (внизу) |
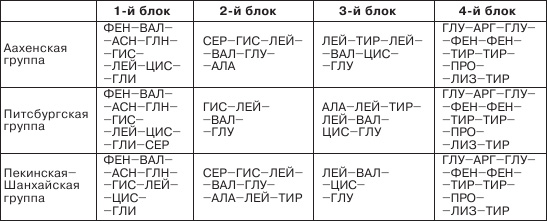
Короткую цепь все три группы собирали одинаково, то есть из одних и тех же двух блоков: 1-й блок — ГЛИИЛЕ-ВАЛ-ГЛУ-ГЛН-ЦИС-ЦИС-ТИР-СЕР; 2-й — ИЛЕ-ЦИС-СЕР-ЛЕЙ-ТИРГЛН-ЛЕЙ-ГЛУ-АСН-ТИР-ЦИС-АСН.
Длинную цепь собирали из четырех блоков, однако длина этих блоков у разных групп несколько различалась, и одинаковым у всех авторов оказался только четвертый блок (см. таблицу).
Различия возникли из-за того, что неодинаковыми были и методы соединения блоков, и методы промежуточной защиты. Естественно, на последнем этапе у всех авторов получились одинаковые цепи. Приблизительно год ушел на создание исходных блоков. Поскольку конкуренты явно поджимали, аахенская группа стала работать быстрее ив декабре 1963 года сообщила об успешном синтезе инсулина. Немцы буквально вырвали первенство у питсбургских химиков, которые сообщили об успешном результате в марте 1964 года. Окончательный выход чистого продукта колебался от 0,02 до 0,07%. У китайских химиков выход был несколько выше (1,2–2,5%), но, разумеется, о промышленном производстве инсулина по таким методикам не могло быть и речи.
Вернемся к началу нашего рассказа, то есть к аналогии с альпинизмом. Самые высокие вершины мира находятся в Гималаях — там четырнадцать восьмитысячников (вершин с высотой более 8000 м.) Покорение каждой из этих вершин было крупным событием. Вершину Чо-Ойю (8158 м.) в 1954 году пытались покорить одновременно австрийская и швейцарская экспедиции, причем обе видели друг друга издалека. Острое желание не упустить приоритет восхождения вынудило австрийцев поторопиться и начать раньше намеченного нелегкий штурм, который увенчался полной победой. Вся слава обычно достается первым, и это вполне заслуженно — они снимают психологический барьер, показывая всем последователям, что задачу можно решить.
Синтез инсулина стал убедительной победой классической синтетической химии пептидов. Несмотря на низкий выход продукта, все признавали, что была проделана выдающаяся работа, которая позволила изменить образ мышления химиков, сформулировать новые принципы сборки больших молекул, отработать стратегию синтеза. Все это заметно повысило общий уровень органической химии. Тем не менее истинного триумфа не получилось, потому что почти одновременно с успешным завершением этих работ появилась принципиально иная, более совершенная методика сборки белковых молекул.
Главное — закрепить хвост
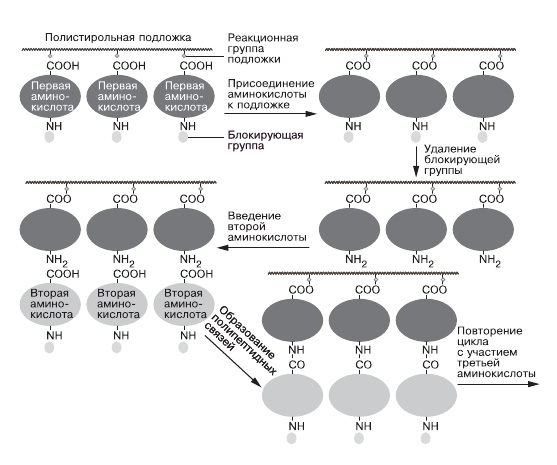
Профессор Рокфеллеровского университета (Нью-Йорк) Роберт Меррифилд, занимаясь химией белков, высказал оригинальную идею: первую аминокислоту можно закрепить одним концом на нерастворимой поверхности. Затем надо присоединить к другому ее концу следующую аминокислоту, при этом нежелательные побочные продукты и промежуточные реагенты, не вступившие в реакцию, можно будет вымывать из реакционного сосуда после каждой стадии, а растущий полипептид, прикрепленный к носителю, останется при этом незатронутым. Молекулы растущих полипептидов будут подвешены «за хвост» к твердой поверхности, а когда процесс синтеза завершится, конечный полипептид можно отделить от носителя (рис. 5).
 |
|
5.Синтез полипептидных цепей на подложке |
Меррифилду удалось реализовать эту идею. Первую аминокислоту присоединили к нерастворимому полимерному гелю (сшитый полистирол) с введенными в него хлорметильными группами – CH2Cl, которые реагировали с СООН — группами аминокислоты. Чтобы взятая для реакции аминокислота не прореагировала сама с собой или не присоединилась H2N-группой к подложке, аминогруппу предварительно блокируют объемистым заместителем [(С4Н9)3]3ОС(О)-группой. После того как аминокислота присоединилась к полимерной подложке, блокирующую группу удаляют и в реакционную смесь вводят другую аминокислоту, у которой также предварительно заблокирована H2N-группа. В такой системе реагируют только H2Nгруппа первой аминокислоты и СООН-группа второй. Далее всю схему повторяют, пока не получится нужная длина цепи. На последней стадии полученные полипептидные цепи отделяют от полистирольной подложки с помощью HBr в присутствии трифтор-уксусной кислоты F3CCOOH.
Меррифилд не только экспериментально проверил эффективность метода, но и сконструировал аппарат, который практически автоматизировал пептидный синтез. Это устройство выглядело как контейнер с автоматическими впускным и выпускным клапанами и программным механизмом, который регулировал последовательность реакций и длительность каждой стадии.
Вернемся снова к покорению вершины Чо-Ойю. За два года до того, как на нее взошли австрийские альпинисты, экспедиция английского альпийского клуба пыталась покорить эту вершину. На высоте 6600 м. альпинисты увидели перед собой гигантский ледяной сброс, преградивший путь. Решив, что для преодоления препятствия потребуется несколько недель, альпинисты отменили восхождение. Через два года шерп-носильщик Пазанг Дава-Лама, находившийся в составе австрийской экспедиции, сумел преодолеть этот ледяной сброс всего за час — просто он нашел правильный путь.
Часто иной подход к решению задачи делает возможным невозможное. С помощью своего аппарата Меррифилд и его коллеги синтезировали инсулин всего за 20 дней (притом с выходом в десятки процентов), в то время как «первопроходцы» — аахенская, питсбургская и шанхайская группы — затратили на это больше года.
В 1985 году Меррифилд «за развитие методологии твердофазного химического синтеза» был удостоен Нобелевской премии.
Копируем природу
Во время всех этих исследований химиков не оставляла мысль, что задачи, над которыми они бьются, природа решает легко и исключительно аккуратно. Ведь синтез белков в живых организмах проходит в мягких условиях, быстро и без побочных продуктов. До определенного момента химики лишь с удивлением и интересом наблюдали за подобными синтезами, однако стремительное развитие биохимии позволило активно вмешаться в эти процессы и найти принципиально новый способ синтеза инсулина.
Ранее мы упомянули, что Ф.Сенгер, установивший структуру инсулина, сумел определить последовательность фрагментов в структуре знаменитой двойной спирали ДНК, за что получил вторую Нобелевскую премию. Эта работа позволила биохимикам перейти к следующему этапу — встраивать в последовательность ДНК нужные фрагменты. Основная идея состояла в том, чтобы в ДНК некоторых бактерий включать гены высших организмов.
В результате бактерии приобретают способность синтезировать соединения, которые прежде могли синтезировать только животные. Такая технология получила название «генная инженерия».
В 1981 году канадского биохимика Майкла Смита пригласили в научные соучредители новой биотехнологической компании «Зимос». Один из первых контрактов фирма заключила с датской фармацевтической компанией «Ново», которая просила разработать технологию производства человеческого инсулина в дрожжевой культуре. В результате совместных усилий это было сделано, ив 1982 году инсулин, полученный по новой технологии, поступил в продажу. В 1993 году за работы в этой области М.Смит (совместно с К. Муллисом) получил Нобелевскую премию. Сегодня инсулин, полученный методом генной инженерии, практически вытеснил инсулин животных.
Чьи работы важнее?
Мы познакомились с четырьмя способами получения инсулина: из поджелудочной железы животных (Д.Маклеод), многоступенчатым синтезом (Г.Цан), автоматизированная сборка (Р.Меррифилд), методом генной инженерии (М.Смит). Оставим в стороне медицинский аспект проблемы и сосредоточимся на химии. У вас могло сложиться впечатление, что работы М.Смита обесценили все предшествующие исследования. На самом деле это не так, поскольку все методы неразрывно связаны и ни один из этапов исследований нельзя «выбросить». Инсулин, выделенный из поджелудочной железы животных, позволил Ф.Сенгеру определить его структуру, а без этого никакой последующий синтез был бы невозможен. Группа Цана разработала химические приемы сборки цепей и способы промежуточной блокировки функциональных групп, которыми воспользовался Меррифилд при создании автоматической установки синтеза. Работы Смита, по существу, опирались на весь предшествующий опыт, накопленный при изучении инсулина. При синтезе некоторых короткоцепочечных гормонов автоматическая установка Меррифилда оказалась предпочтительнее, нежели генноинженерные методы.
Обобщая, можно сказать, что все этапы — это естественный, традиционный и, если не бояться торжественных слов, величественный путь науки.
