Зеленая химия: очередная промышленная революция?
 Про сверхкритические жидкости (газы или жидкости, при определенном давлении и температуре переведенные в необычное состояние) „Химия и жизнь“ подробно рассказывала в февральском номере 2000 года. В сверхкритическом состоянии такие всем известные вещества, как углекислый газ или вода, приобретают необычные свойства, например становятся мощными растворителями, по свойствам сравнимыми с традиционными органическими — и при этом совершенно безопасными. К теме сверхкритических жидкостей нас заставил вернуться второй семинар для молодых ученых по „Зеленой химии и катализу“, который прошел в начале апреля на Химическом факультете МГУ.
Про сверхкритические жидкости (газы или жидкости, при определенном давлении и температуре переведенные в необычное состояние) „Химия и жизнь“ подробно рассказывала в февральском номере 2000 года. В сверхкритическом состоянии такие всем известные вещества, как углекислый газ или вода, приобретают необычные свойства, например становятся мощными растворителями, по свойствам сравнимыми с традиционными органическими — и при этом совершенно безопасными. К теме сверхкритических жидкостей нас заставил вернуться второй семинар для молодых ученых по „Зеленой химии и катализу“, который прошел в начале апреля на Химическом факультете МГУ.
Первый такой семинар состоялся в прошлом году в Ноттингемском университете где лабораторией чистых технологий руководит профессор Мартин Поляков. Вклад этого ученого в новые чистые химические технологии с использованием сверхкритических сред неоценим. А его лаборатория — одна из ведущих в Европе, занимающаяся зеленой химией. Причем там не только проводят фундаментальные исследования. Новые технологии отрабатывают на лабораторных установках и в содружестве с фирмой „Thomas Swan & Со“, специализирующейся на тонкой химии, запускают в серийное производство. Кстати, на Химфаке МГУ тоже есть лаборатория, которая занимается сверхкритическими средами. Она тесно сотрудничает с Ноттингемским университетом (до настоящего времени только в области фундаментальной науки) и поэтому именно в Московском университете на семинаре „Зеленая химия и катализ“ молодые ученые и студенты рассказывали о своих иссследованиях в этой области. Семинар в Москве открыл профессор Мартин Поляков, из выступления которого слушателям стало ясно, что стереотипное представление о химической промышленности, с трубами, дымящими в небо, и потоками химических отходов, сливающихся в реки, скоро, возможно, изменится.
Двенадцать принципов зеленой химии
1. Лучше предотвратить потери, чем перерабатывать и чистить остатки.
2. Методы синтеза надо выбирать таким образом, чтобы все материалы, использованные в процессе, были максимально переведены в конечный продукт.
3. Методы синтеза по возможности следует выбирать так, чтобы используемые и синтезируемые вещества были как можно менее вредными для человека и окружающей среды.
4. Создавая новые химические продукты, надо стараться сохранить эффективность работы, достигнутую ранее, при этом токсичность должна уменьшаться.
5. Вспомогательные вещества при производстве, такие, как растворители или разделяющие агенты, лучше не использовать совсем, а если это невозможно, их использование должно быть безвредным.
6. Обязательно следует учитывать энергетические затраты и их влияние на окружающую среду и стоимость продукта. Синтез по возможности надо проводить при температуре, близкой к температуре окружающей среды, и при атмосферном давлении.
7. Исходные и расходуемые материалы должны быть возобновляемыми во всех случаях, когда это технически и экономически выгодно.
8. Где возможно, надо избегать получения промежуточных продуктов (блокирующих групп, присоединение и снятие защиты и т. д.).
9. Всегда следует отдавать предпочтение каталитическим процессам (по возможности наиболее селективным).
10. Химический продукт должен быть таким, чтобы после его использования он не оставался в окружающей среде, а разлагался на безопасные продукты.
11. Нужно развивать аналитические методики, чтобы можно было следить в реальном времени за образованием опасных продуктов.
12. Вещества и формы веществ, используемые в химических процессах, нужно выбирать таким образом, чтобы риск химической опасности, включая утечки, взрыв и пожар, были минимальными.
Научное направление под названием „зеленая химия“ возникло в 90-х годах XX века и довольно быстро нашло сторонников в химическом сообществе. Новые схемы химических реакций и процессов, которые разрабатывают во многих лабораториях мира, призваны кардинально сократить влияние на окружающую среду крупнотоннажных химических производств. Химические риски, неизбежно возникающие при использовании агрессивных сред, производственники традиционно пытаются уменьшить, ограничивая контакты работников с этими веществами. Зеленая химия предполагает другую стратегию — вдумчивый отбор исходных материалов и схем процессов, который вообще исключает использование вредных веществ. Если риск = случай × экспозиция, при случай = 0 и риск будет равным 0, следовательно, нет необходимости контролировать производство. Конечно, это скорее идеал, чем ближайшая цель. Но ближайшая цель и состоит в том, чтобы как можно быстрее достичь идеала. Впрочем, после знакомства с 12 принципами зеленой химии становится понятно, что путь этот неблизкий.
Пути, по которым уже сейчас движется зеленая химия, можно сгруппировать в три большие направления:
1) новые пути синтеза (часто это реакции с применением катализатора);
2) возобновляемые исходные реагенты (то есть полученные не из нефти);
3) замена традиционных органических растворителей.
Второй пункт — это тема для отдельного подробного разговора. Каталитические реакции давно и успешно применяют в некоторых промышленных процессах. Третье же направление — именно то, что изменит наши представления о промышленной химии.
И все же немного о катализе
Традиционная органическая химия предполагает многостадийные процессы, в результате которых из исходных веществ получаются продукты. Но схемы и механизмы реакций, подходящие для лаборатории, совершенно не годятся для крупнотоннажных процессов. Если на каждой стадии реакция идет с выходом, далеким от 100%, то при переносе на большой масштаб вместе с нужным продуктом получаются огромные количества ненужных веществ. В цепочке реакций используют вспомогательные вещества, часто после кислотной или щелочной нейтрализации образуются неорганические соли (хлорид натрия, сульфат натрия, сульфат аммония). Что касается потерь, то в многоступенчатых процессах они бывают выше, чем конечный выход продукта. Эту проблему химических и фармацевтических производств отчасти помогают решить катализаторы, которые существенно уменьшают выход нежелательных побочных продуктов.
В нефтепроизводствах и крупнотоннажной основной химии почти 75% продуктов получены каталитическим методом. В каталитических процессах, как правило, степень использования исходного продукта довольно высокая. Например, при получении уксусной кислоты с помощью родиевого катализатора (технология „BP-Monsanto“) метанол расходуется на 100%:
CH3OH + CO = CH3COOH
Полнота использования исходного вещества называется атомной эффективностью, и этот показатель можно использовать как меру „зелености“ химического производства:
Атомная эффективность = Кол-во атомов в продукте × 100%/Кол-во атомов в исходных веществах.
Естественно, процесс в одну стадию А + В = С (например, полимеризация этилена) гораздо эффективнее, чем А + В = С (нужный продукт) + D(побочный продукт). Идею атомной эффективности Р. Шелдон выражал через Е-фактор, который показывает количество потерь на килограмм продукта (табл. 1).
| Промышленность | Кол-во тонн продуктов | Соотношение, кг (Е) побочный продукт/
нужный продукт |
| Нефтехимическая | 106-108 | -0,1 |
| Крупнотоннажная основная химия | 104-106 | <1-5 |
| Тонкая химия | 102-104 | 5–50 |
| Фармацевтическая | 101-103 | 25–100+ |
В Великобритании эти расчеты „зелености“ вышли из академического на государственный масштаб, и недавно был создан виртуальный Институт прикладного катализа, цель которого — поддерживать взаимодействие ученых и промышленных технологов в этой области.
Замена растворителей
Еще одно направление зеленой химии — замена растворителей в технологических процессах. Растворители выполняют несколько функций: они играют роль транспорта (разведение краски, удаление грязи) или помогают смешивать компоненты. Также их используют для того, чтобы доставить или убрать тепло, более эффективно смешать реагенты или контролировать их реакционную способность. Абсолютное большинство растворителей, применяемых сейчас, — это летучие органические вещества, производные нефти. Следовательно, они во-первых, не бесконечны, во-вторых, пожаро-и взрывоопасны, а в-третьих, вредны для окружающей среды. Как от них избавиться? Можно проводить химический процесс вообще без растворителя; можно использовать в качестве растворителя воду, биоразлагающиеся „зеленые“ растворители, ионные жидкости (соли, плавящиеся при низких температурах), сверхкритические жидкости.
Понятно, что как не существует универсального органического растворителя, так и „зеленые“ растворители надо подбирать — для каждой реакции свой. Например, реакция без растворителя удобна с экономической и экологической точек зрения, однако на практике довольно сложно осуществима — и то лишь в редких случаях, когда оба реагента — жидкости или один из них может служить растворителем. Вода тоже очень удобна, но, к сожалению, органические вещества обычно нерастворимы в воде. Примером „зеленого“ растворителя может служить перфторан. Правда, он довольно дорог на Западе (в России значительно дешевле), поэтому вряд ли его будут использовать в широких масштабах. Таким образом, на сверхкритические жидкости возлагают большие надежды.
Сверхкритические жидкости — это газы, сжатые до такого состояния, что они почти становятся жидкостями (см. „Химию и жизнь“, 2000, № 2), то есть их плотность приближается к плотности жидкости. Такое состояние возможно только при температурах более высоких, чем так называемые критические, поскольку ниже этого порога газ под давлением просто превратится в жидкость. Жидкости, например воду, тоже можно перевести в сверхкритическое состояние при определенном давлении и температуре. Критическая температура для наиболее часто используемых веществ изменяется в довольно широких пределах (табл. 2).
Критические температуры
некоторых сверхкритических флюидов
| Вещество | Критическая температура, oC |
| СО2 | 31 |
|
C2H4 | 9 |
| NH3 | 132 |
| H2O | 374 |
Сверхкритические среды привлекают внимание физхимиков последние 150 лет. Действительно, газ, который приобретает некоторые свойства жидкости, — многообещающий объект для изучения. Тем не менее технологический интерес к сверхкритическим жидкостям появился относительно недавно. Основная причина этого интереса — то, что они становятся такими же хорошими растворителями, как известные органические, а иногда бывают и лучше. При этом они совершенно безвредны для окружающей среды. Как только продукт получен, можно убрать давление, и газ (например, CO2) просто возвращается в атмосферу.
В начале 80-х годов был всплеск фундаментальных исследований по возможному промышленному применению сверхкритических жидкостей, но, к сожалению, их сторонники переоценили свой продукт. Новые растворители оказались слишком дороги. Сейчас ситуация меняется. В связи с серьезной озабоченностью ученых загрязнением окружающей среды необычные растворители опять выходят на первый план. Но все-таки это не основная причина, по которой ученые снова вернулись к этим объектам. Последние фундаментальные исследования доказали, что сверхкритические жидкости могут обеспечить такой уровень контроля и превращения в химических реакциях и при обработке материалов, которого трудно достичь традиционными методами.
Сверхкритические жидкости в действии
Сверхкритический CO2 (scCO2) имеет почти такую же растворяющую способность, как гексан, и это его свойство используется в пищевой промышленности. Например, кофеин из зерен зеленого кофе извлекают именно с помощью scCO2, причем в огромных масштабах. Углекислый газ экстрагирует только кофеин, оставляя все ароматные компоненты и не оставляя после себя никакого вредного следа, в отличие от своих органических „коллег“. Подобную технологию также используют для экстракции хмеля при производстве пива, никотина из табака, а также различных ароматических веществ в парфюмерной промышленности.
Сейчас заметно возросли усилия исследователей по замене органических растворителей на scCO2 и в других промышленных процессах. Причем не только химических, но и чисто технических, например таких, как очистка машинных деталей от масла. Однако многие органические растворители, хоть и с потерями, можно очищать и использовать повторно. Какой же резон промышленникам переключаться на сверхкритические растворители? К счастью, для них есть не только кнут, но и пряник. Использование традиционных растворителей становится все более дорогим, а реакции в scCO2 не только экологически чисты, но зачастую и более эффективны. Например, фирма „Дюпон“ в ближайшем будущем собирается внедрить технологию производства фторполимеров, предполагающую использование сверхкритического CO2. Новая технология позволит лучше контролировать физические свойства фторполимера и его химический состав.
Лаборатория чистых технологий Ноттингемского университета часть своих усилий сосредоточила на применении сверхкритического CO2 в органических реакциях, в частности гидрирования. Все началось с теоретического исследования: синтеза органометаллических соединений переходного металла в сверхкритическом ксеноне в спектроскопической ячейке. А закончилось — проточным реактором фирмы „Thomas Swan & Со“, использующим сверхкритические жидкости. В нем можно проводить много различных реакций, в том числе гидрирование (рис.1) . При традиционных технологиях гидрирование часто идет с трудом, поскольку водород плохо растворяется в органике. В сверхкритической среде растворитель, водород и субстрат находятся в одном состоянии. Таким образом, процесс протекает более интенсивно, и к тому же непрерывно. Газоподобные свойства сверхкритической жидкости уменьшают вязкость реакционной смеси, за счет этого увеличивается ее приток к поверхности катализатора. С другой стороны, плотность, соответствующая жидкости, позволяет лучше проводить тепло, чем в газовой фазе.
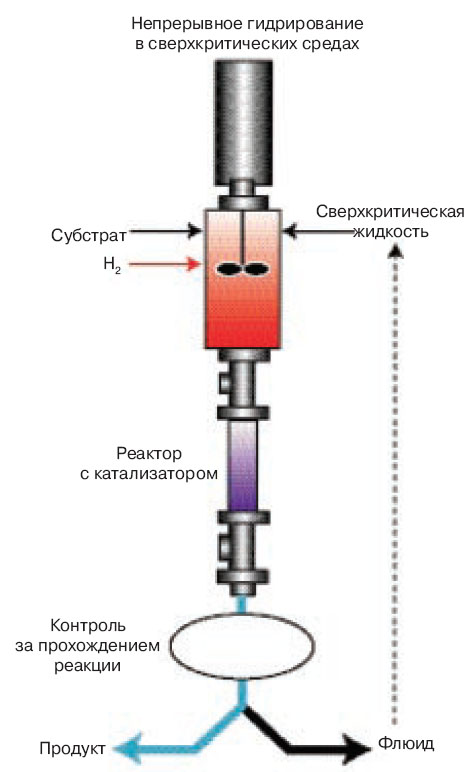 |
|
Рис. 1. Схема проточного реактора для гидрирования органических соединений в scCO2 или сверхкритическом пропане. Сверхкритический CO2, водород и органический субстрат смешиваются в подогреваемом реакторе, оттуда смесь поступает в реактор, содержащий закрепленный катализатор (обычно благородн |
Реакция гидрирования изофорона в сверхкритических жидкостях (рис. 2) более селективна, проходит с большей скоростью и позволяет эффективнее использовать катализатор. Проточный реактор ученые теперь также используют для непрерывного алкилирования ароматических соединений по Фриделю-Крафтсу и синтеза эфиров (с использованием твердых кислотных катализаторов). Алкилирование получается, во-первых, гораздо более чистым, чем традиционный процесс, поскольку не предполагает использование хлорида алюминия, а во-вторых, гораздо более избирательным.
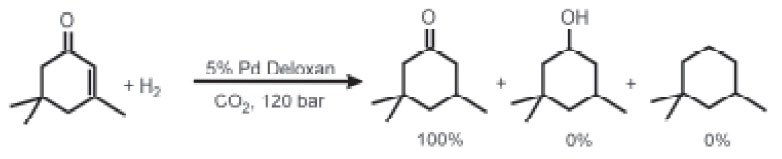 |
|
Рис. 2. Гидрирование изофорона. Делаксан — твердая полиаминосилокса |
Как внедрить «зеленый» процесс
Внедрение — задача трудная даже для промышленно развитых стран. В Великобритании, например, сейчас всячески поощряют взаимодействие ученых и химиков-технологов — раньше такого практически не было. Создаются даже совместные центры для внедрения „зеленой“ химии.
В Ноттингемском университете впервые в мире начали читать курс по зеленой химии для студентов-химиков и химиков-технологов последнего года обучения. Старшекурсников учат рассматривать химико-технологический процесс в целом, а не фрагментарно. Сегодня уже недостаточно, чтобы специалист мог подобрать традиционный или наиболее дешевый реагент для промышленного синтеза, необходимо держать в уме весь процесс от начала до конца. Первичные источники исходного реагента (добываемые или возобновляемые); как этот реагент получают; атомная эффективность реакции; растворители — их минимизация или использование нетоксичных растворителей; селективность выхода (низкий выход возможен только в случае, если в реакции нет побочных продуктов или если исходное вещество можно использовать повторно); стоимость побочных продуктов (может быть настолько высока, что обеспечит жизнеспособность процесса)… Словом, рассказать обо всем химическом процессе от получения исходных продуктов до конечного результата — это само по себе гигантская работа. А чтобы еще производство получилось „зеленым“ да не очень дорогим…
P. S. Благодаря совместному семинару для молодых ученых „Зеленая химия и катализ“, который теперь должен стать традиционным и ежегодным, появилась надежда, что и наши химики-технологи когда-нибудь задумаются об „озеленении“ химического производства, тем более что у нас есть интересные работы в этой области.
