Если нельзя, но очень хочется
Нобелевскую премию по химии в 2014 году получили Эрик Бетциг (США), Штефан Хелль (Германия) и Уильям Мёрнер (США) «за развитие сверхразрешающей флуоресцентной микроскопии».
Нобелевская премия за микроскопию не первая, в 1986 году ее присудили Эрнсту Руске «за фундаментальную работу по электронной оптике и создание первого электронного микроскопа», а также Герду Биннигу и Генриху Рореру «за изобретение сканирующего туннельного микроскопа». Правда, это была премия по физике, а не по химии. Электронный микроскоп — универсальный прибор, который используют почти все области науки. Сканирующий туннельный микроскоп (и его модификация — атомно-силовой микроскоп) имеет огромное значение для материаловедения, его применяют для исследования поверхности твердых тел. Что же касается флуоресцентной микроскопии, то она предназначена для изучения биологических систем, поэтому внимание Нобелевского комитета, вполне в духе современных биоцентрических взглядов на науку, обратилось именно к нему.
Запрещенные и разрешенные переходы
Люминесценция — это спонтанное нетепловое излучение. Нетепловое (то есть не в инфракрасном диапазоне) излучение обусловлено электронными переходами — перескоками электронов с более высокого уровня энергии на более низкий. Если оба состояния имеют одинаковый спин, то переход называется разрешенным, а такая разновидность люминесценции — флуоресценцией. Вероятность перехода определяет среднее время жизни возбужденного состояния: соответственно чем выше вероятность, тем короче время жизни, и наоборот.
Обычно флуоресценцию (и вообще люминесценцию) наблюдают, «накачивая» вещество световой энергией, то есть интенсивно облучая светом в видимом или ультрафиолетовом диапазоне. После облучения (и даже во время его) вещество отдает часть энергии обратно, при этом длина волны излучаемых квантов несколько больше, чем у исходных. Именно так светится циферблат часов после солнечного дня, если цифры покрыты специальным веществом — люминофором (а вовсе не фосфором!).
Вероятность запрещенных переходов намного ниже, чем разрешенных (отсюда и название), время жизни таких возбужденных состояний намного больше, но и интенсивность свечения гораздо ниже. Поэтому для микроскопии интересно излучение за счет разрешенных переходов — флуоресценция.
Методика и метки
Стандартная методика флуоресцентной микроскопии заключается в следующем. На объекте исследования закрепляют некоторое количество меток, то есть небольшие флуоресцентные молекулы. О таких молекулах см. статью Е.О.Пучкова, «Химия и жизнь», 2014, № 9. Образец облучают светом с определенной длиной волны (или, если свет не монохромный, — с длинами волн, лежащими в определенном диапазоне), вызывая флуоресценцию меток, а затем улавливают их свечение, которое и дает изображение. Впрочем, образец поглощает не весь возбуждающий свет: часть отражается и попадает в объектив, ухудшая качество картинки. Но поскольку при флуоресценции длина волны испускаемого света больше, чем возбуждающего, отраженный свет отделяют при помощи фильтра.
Интересно, что Нобелевская премия по химии 2008 года тоже имела прямое отношение к флуоресцентной микроскопии. Награду присудили «за открытие и разработку методов использования зеленого флуоресцентного белка GFP» («Химия и жизнь», 2008, № 11), который широко применяют в качестве метки при исследовании живых клеток. Он гораздо менее токсичен, чем многие флуоресцентные молекулы меньшего размера, более того — клетка может синтезировать его сама, если внедрить в нее соответствующий ген.
Размеры и барьеры
Размеры многих биообъектов субклеточного уровня не превышают 150 нм по одному из линейных измерений. Например, диаметр рибосомы — 15—30 нм, а толщина клеточной мембраны не более 10 нм. С другой стороны, физика накладывает ограничения на разрешающую способность оптических приборов: если два источника света расположены слишком близко друг к другу, то их изображения будут перекрываться из-за волновой природы света. Это расстояние называется дифракционным пределом, или барьером, и оно равно половине длины волны света, деленной на показатель преломления среды. Поскольку длины волн в видимой области спектра имеют порядок сотен нанометров (380—740 нм), то, например, можно рассмотреть органеллы клетки, размеры которых исчисляются сотнями нанометров, — ядро, митохондрии, лизосомы, — но изучить в деталях более мелкие структуры уже не получится. Тем не менее Бетциг, Хелль и Мёрнер показали, что если дифракционный предел преодолеть нельзя, но очень хочется, то можно.
Подавление вместо стимуляции и другие хитрости
Речь идет, конечно, не об отмене законов физики, а о технических хитростях. Допустим, метки расположены друг к другу ближе, чем дифракционный предел. Если они будут излучать одновременно, то сольются в световое пятно, как огни большого города, видимые с самолета. Но если «включать» флуоресценцию по очереди, то в одном участке, то в другом, удастся рассмотреть подробности, а совместив много изображений, на каждом из которых светятся другие молекулы, — получить разрешение выше дифракционного барьера и создать субдифракционный (сверхразрешающий) микроскоп.
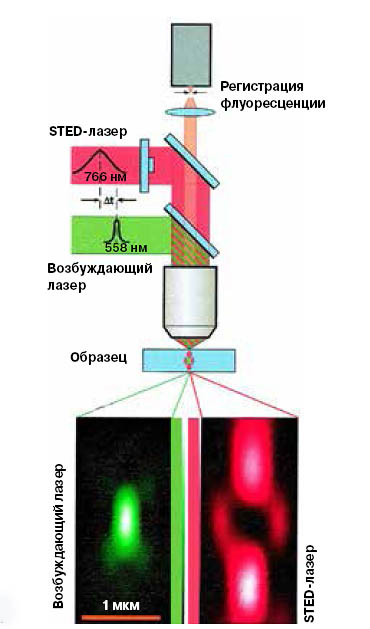
Один из способов «погасить» часть меток основан на эффекте вынужденного подавления испускания (STED - Stimulated Emission Depletion) — метод, за который получил Нобелевскую премию Штефан Хелль. В STED-микроскопе работают два лазерных луча: возбуждающий и тушащий. Последний кольцом охватывает первый, и оба движутся по образцу, выхватывая из темноты участок за участком. В «кольце тушения» происходит следующее: до того как накачанная возбуждающим лучом метка испустит фотон, ее освещает тушащий луч, принуждая к переходу на нижний электронный уровень. Какая длина волны будет у испущенного при этом света — зависит от длины волны второго лазера, но в любом случае она будет несколько отличаться и от возбуждающего лазера, и от флуоресцирующей в штатном режиме метки. Следовательно, такое излучение отфильтруется вместе с отраженным, то есть как бы погашено, — при этом регистрируется только сигнал от маленького участка внутри кольца. В итоге мы строим изображение поэтапно, точку за точкой. А поскольку размер точки — порядка десяти нанометров, тем самым и достигается сверхразрешение. Уже в статье 2000 года Хелль с соавторами опубликовали изображения клеток кишечной палочки с разрешением, в несколько раз превосходящим дифракционный барьер (Klar et al., «Proceedings of the National Academy of Sciences USA», 2000, 97, 8206—8210, doi: 10.1073/ pnas.97.15.8206).
|
|
1. STED-микроскопия: принцип метода (Klar et al., 2000) |

|
|
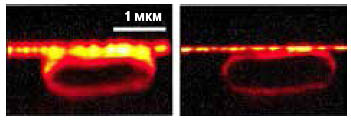
3. Еще пример из статьи Хелля и соавторов 2008 года: самоорганизующаяся коллоидная система, слева — конфокальная микроскопия, справа STED-микроскопия. Масштабная линейка 1 мкм, во врезах 250 нм (Harke et al., «Optics Express», 2008, 16, 6, 4154—4162, doi: 10.1364/OE.16.004154) |
Бетцигу принадлежит идея, что можно добиться субдифракционного разрешения, собирая информацию от меток, излучающих в разное время, и совмещая изображения. Специальная обработка каждого кадра позволяет «сузить» сигналы отдельных молекул, в результате при совмещении они не сливаются (Betzig, «Optics Letters», 1995, 20, 237—239, doi: 10.1364/ OL.20.000237). Реализовать эту идею на практике помогли фотоуправляемые флуоресцентные репортеры — GFP и его разноцветные производные. Метод получил название PALM — Photo-Activated Localization Microscopy (Betzig et al., «Science», 2006, 313, 1642—1645, doi: 10.1126/science.1127344).

|
| 2. Клетка кишечной палочки: конфокальная микроскопия и STED-микроскопия. Легко видеть, насколько улучшилось разрешение (Klar et al., 2000) |
Мёрнер, работая с флуоресцентными белками, полученными в лаборатории Роджера Тсиена — нобелевского лауреата 2008 года, сумел показать, что фотоуправляемая флуоресценция возможна (Dickson et al., «Nature», 1997, 388:355— 358). Оказывается, изменяя режимы облучения образца, можно включать и выключать свечение определенного белка. Так, молекулы мутантной формы зеленого флуоресцентного белка после облучения лазерным лучом с длиной волны 488 нм проходят через несколько циклов излучения, то есть сначала начинают «мигать», а затем переходят в стабильное «темное» состояние. Облучение с длиной волны 405 нм снова нажимает на кнопку «вкл». А если образец содержит флуоресцентные метки, которые поочередно включаются и выключаются (чтобы включились не все сразу, световой импульс должен быть слабым), это именно то, что нужно для реализации идеи Бетцига — рассматривать молекулы по отдельности и регистрировать светящиеся точки, а не размытое световое пятно. Такие интересные манипуляции возможны благодаря конформационному разнообразию и сложной электронной структуре флуоресцентных белков. Кстати, существенный вклад в изучение фотоактивирующихся флуоресцентных белков внесли российские исследователи из Института биоорганической химии РАН.
|
|
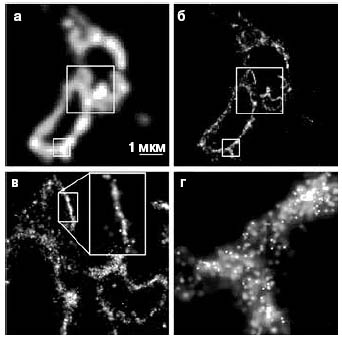
4. А вот преимущество PALM перед TIRF (флуоресценция, основанная на полном внутреннем отражении, — Total Internal Reflection Fluorescence, она же микроскопия затухающего поля), одним из методов флуоресцентной микроскопии, который в принципе тоже используется для визуализации отдельных молекул. Панель а — TIRF, б, в, г — PALM, причем в, г — увеличенные врезы с фото б. Расположение в мембране лизосомы белка, несущего флуоресцентную метку, показано детально (Betzig et al., 2006) |
Сегодня уже разработано несколько новых родственных разновидностей сверхразрешающей флуоресцентной микроскопии. Но именно рассмотренные нами методы впервые позволили заглянуть за дифракционный барьер.
Физика и техника для биологии
В «Структуре научных революций» Томас Кун отмечал исключительную важность совершенствования экспериментальных методов исследования для развития науки. Работы Бетцига, Хелля и Мёрнера могут служить прекрасной иллюстрацией к идеям знаменитого философа и историка науки. Развитие субдифракционной флуоресцентной микроскопии потребовало от ее пионеров исключительной квалификации в области физики и техники, особенно квантовой оптики. Созданные ими методы имеют огромное значение для исследования процессов на субклеточном уровне.
